근래 인도발 델타변이 전 세계적으로 급격히 확신이 되고, 국내에서도 확진자 규모가 날이 갈수록 늘어가다 보니, 다시금 금 국내 시장에서는 진단키트 주가 주목을 받고 있습니다. 특히 이전에는 씨젠을 비롯한 초기 FDA로부터 긴급사용허가승인을 받았던 종목들부터 수출허가가 났다고만 하면, 주가가 상승했던 것과 다르게 근래 들어서는 2020년에 호실적을 기록한 종목들 위주로 상승랠리가 나오고 있습니다.
그중 제가 관심있게 보는 것은 면역진단 쪽으로 신속진단업체 중 '액세스바이오'라는 회사의 제품인데요. 얼마 전 우연찮게 엑세스바이오의 신속진단키트인 Carestart antigen에 대해서 미국에서 나온 성능에 관한 논문을 발견하게 되어, 이에 대한 내용 정리와 더불어 현재 항원 진단키트의 No. 1이라고 하는 애보트사의 신속진단키트인 BinaxNow와 비교해보았습니다.
참고로, 본 글은 엑세스바이오에 대한 회사 주식 매수추천이 아님을 미리 밝혀둡니다.
신속진단키트의 작동원리

일반적으로 항원진단키트와 같은 신속진단키트는 아래와 같이 기본적으로 채취한 검체를 샘플 패드(Sample pad)에 떨어뜨려 흡수시키면, 시간이 지나면서 흡수된 검체가 패드를 따라 이동하면 니트로 셀룰로오스 멤브레인에 고정되어 있는 항체에 달라붙게 되는데, 이때 항체가 결합되어 있는 곳에 부착된 금 입자 패드의 색상이 변화되면서, 감염유무를 확인할 수 있게 됩니다.
결론적으로 신속진단키트의 성능을 좌우하는 것은 민감도를 높이는 기술이며, 이를 좌우하는 요소는 크게 두 가지로
1. 얼마나 강하게 검체(병원성)에 특이적으로 달라붙는 항체를 보유하고 있는가
2. 결합시, 테스트 라인이 선명하게 발색될 수 있도록 하는 발색 기술
이라고 볼 수 있겠습니다.
엑세스바이오의 항원진단키트에 사용된 항체는
작년 1월에 중국에서 코로나바이러스가 퍼지고 있다는 소식과 함께 국내에서도 다양한 연구기관 및 기업들에서 진단기기를 개발하기 시작했습니다.
엑세스바이오의 경우엔, 자회사인 웰스바이오를 통해서 한국화학연구원과 2019년부터 메르스바이러스에 대한 진단키트를 함께 개발해오고 있었는데, 코로나바이러스가 확산되기 시작하자, 바로 함께 진단기술을 개발하는 MOU를 체결하였습니다.
https://www.hellodd.com/news/articleView.html?idxno=70928
'신종코로나' 잡는 기술 출연연이 개발한다 - 헬로디디
신종 코로나 바이러스(이하 신종 코로나)가 세계적으로 확대되는 가운데 정부출연연구기관의 융합연구단에서 진단 기술 개발을 위한 준비를 완료하고 박차를 가하고 있어 귀추가 주목되고 있
www.hellodd.com
제가 찾아본 결과로는 100% 확실하지는 않으나, 초기 제작한 항원진단키트에 들어가는 항원식별용 항체는 앱클론에서 찾아낸 항체를 사용한 것으로 추측됩니다. 이러한 추론의 근거는 아래 링크된 기사의 일부를 인용해보면 웰스바이오와 함께 협업한다는 내용이 있었기 때문입니다.
항체 신약 개발 전문 기업 앱클론은 정부의 국민생활안전 긴급대응연구사업 신규 과제 '코로나바이러스감염증-19 신속진단제품 개발 과제'의 참여기관으로 선정됐다고 5일 밝혔다.
이에 따라 앱클론은 본 국책과제의 주관기관인 한국화학연구원 산하 신종 바이러스(CEVI) 융합연구단 및 진단키트업체 웰스바이오와 함께 코로나19 진단제 및 치료제 개발을 본격화 및 가속화할 예정이다
https://m.healthcaren.com/news/news_article_yong.jsp?mn_idx=349920
앱클론, 화학연구원과 코로나19 신속진단제 개발 국책 과제 선정 - 헬스케어N - 헬스조선,헬스케
박수현 기자 psh5578@mdtoday.co.kr
m.healthcaren.com
엑세스바이오 항원진단키트에 사용된 발색기술
각종 자료들을 찾아본 결과, 엑세스바이오에서 자체적으로 홍보한 자료는 없으나, 작년 10월 항원진단키트가 미국 FDA로부터 긴급사용허가승인(EUA)을 받은 이후에 관련 기사로 구글에서 뜬 자료가 있는데, 바로 아래 기사입니다.
사실상 기사라기 보단, 관련 기술을 파는 회사의 홍보자료로 보입니다.
CareStart™ COVID-19 Antigen test kit using NanoAct™ launched in the U.S.
/PRNewswire/ -- CareStart™ COVID-19 Antigen test kit developed by Access Bio, Inc., using Asahi Kasei's NanoAct™ cellulose nanobeads, received Emergency Use...
www.prnewswire.com
해당 기사의 내용을 일부 발췌하자면, 엑세스바이오에서 FDA로부터 승인받은 항원진단키트는 Asihi Kasei의 NanoACT 셀룰로오스 나노비드를 사용하였으며, NanoACT라는 제품은 셀롤로오스에 부착된 나노비드에 발색효과를 높여 테스트라인에 가시성을 높였다는 내용입니다.
엑세스바이오의 항원진단키트 성능
이러한 항체와 발색기술을 사용한 엑세스바이오 항원진단키트의 FDA로부터 긴급사용승인을 받았을시의 성능은 아래와 같이 민감도 88.37% 특이도 100%였습니다. 참고로 이때의 검체채취방식은 Nasal Swap방식으로 긴 검체채취키트를 사용하는 방식이었습니다.

그리고 올해 4월 새롭게 수정되어 업데이트된 엑세스바이오의 항원진단키트의 성능은 아래와 같이 민감도 87.18% 특이도 100%이며, 검체체취방식은 Nasal Swap방식이 아닌, 코 안쪽으로부터 채취하는 Anterior 방식으로 변경되었습니다.

최근 엑세스바이오 항원진단키트 성능
일단 제가 찾은 성능평가에 대한 논문 출처는 아래와 같습니다.
https://pubmed.ncbi.nlm.nih.gov/34250188/
Performance and Operational Evaluation of the Access Bio CareStart Rapid Antigen Test in a High-Throughput Drive-Through Communi
CareStart had high sensitivity in people with Ct ≤25 and moderate sensitivity in symptomatic people overall. Specificity was unexpectedly lower in symptomatic versus asymptomatic people. Excellent interoperator agreement was observed, but operational cha
pubmed.ncbi.nlm.nih.gov
본 논문이 등록된 날짜는 2021년 5월 26일로, 본 임상은 2021년 1월 11일부터 22일까지 시행되었습니다. 임상 날짜로만 보면, 현재 FDA 홈페이지에 등록된 엑세스바이오의 성능은 본 임상결과가 반영된 것이라고 합리적이 추론이 가능합니다.

총 참가자 수는 1,603명으로 이중 성인은 1,245명 18세 이하 청소년은 253명이 참여했습니다.
이후에 비교할 애보트사의 BinaxNow와의 비교를 위해, 참가자 중에는 무증상자도 포함되어 있는데
이들의 비중은 성인 참가자 수 중 83%, 18세 이하 청소년의 경우는 87%가 무증상자로 포함되었습니다.

아래 표는 각각이 임상 대상 분류별로 엑세스바이오의 항원진단키트 성능을 정리한 표로, 간략하게 정리하자면 아래와 같습니다. 참고로 대상에 대한 분류는 유증상자 성인 / 무증상자 성인 / 무증상자 청소년 / 유증상자 청소년 으로 나눌 수 있으며, 유증상자의 경우는 다시 증상발현 5일 이내 / 증상발현 7일 이상 자로 세분할 수 있습니다.

엑세스바이오 항원진단키트 대상자 분류별 성능평가 정리
1. 임상대상자 전체(유+무증상자의 성인과 청소년) : 민감도 57.7% 특이도 98.3%
2. 18세 이하 유증상자와 무증상자 전체 : 민감도 56.5% 특이도 96.6%
3. 성인 유증상자와 무증상자 전체 : 민감도 58% 특이도 98.7%
4. 18세 이하 청소년 중 무증상자 : 민감도 51.4% 특이도 97.8%
5. 성인 무증상자 : 민감도 50.0% 특이도 99.1%
6. 18세 이하 청소년 중 증상 발현일이 5일 이내 : 민감도 85.7% 특이도 89.5%
7. 성인 중 증상발현일이 5일 이내 : 민감도 84.8 % 특이도 97.2%
8. 18세 이하 청소년 중 증상발현일이 7일 이내 : 민감도 85.7% 특이도 85.0%
9. 성인 중 증상발현일이 7일 이내 : 민감도 84.3 % 특이도 97.5%
10. 18세 이하 청소년 중 증상발현일이 7일 이상 경과한 자 : 민감도 50.0% 특이도 100%
11. 성인 중 증상발현일이 7일 이상 경과한 자 : 민감도 22.2% 특이도 90.3%
애보트사 BinaxNOW 성능평가
애보트의 BinaxNow 항원진단키트도 이전에 비슷한 경우의 임상을 진행한 적이 있었습니다. 애보트의 경우에는
2020년 10월 26일부터 12월 22일까지 임상을 진행했다고 하니, 엑세스바이오보다 먼저 진행한 것으로 보면 되겠습니다.
해당 임상 평가서에 대한 출처는 아래와 같습니다.
https://pubmed.ncbi.nlm.nih.gov/33622768/
Performance and Implementation Evaluation of the Abbott BinaxNOW Rapid Antigen Test in a High-Throughput Drive-Through Community
Rapid diagnostic tests (RDTs) for SARS-CoV-2 antigens (Ag) that can be performed at point of care (POC) can supplement molecular testing and help mitigate the COVID-19 pandemic. Deployment of an Ag RDT requires an understanding of its operational and perfo
pubmed.ncbi.nlm.nih.gov
애보트의 임상연구의 경우, 총 2,482명이 임상에 참여하였고, 이중 성인은 1,380명 18세 이하 청소년이 928명이 등록되었습니다. 이 임상도 무증상자가 참가하였는데요. 이들의 비중은 성인 참가자 수 중 71%, 18세 이하 청소년에서는 89%가 무증상자로 등록되었습니다.

아래 표는 각각이 임상대상 분류별로 애보트의 항원진단키트 성능을 정리한 표로, 간략하게 정리하자면 아래와 같습니다. 참고로 대상에 대한 분류는 유증상자 성인 / 무증상자 성인 / 무증상자 청소년 / 유증상자 청소년으로 구분되어 있습니다.

애보트사 BinaxNow 대상자 분류별 성능평가 정리
1. 임상대상자 전체(유+무증상자의 성인과 청소년) : 민감도 77.4% 특이도 99.4%
2. 18세 이하 유증상자와 무증상자 전체 : 민감도 69.6% 특이도 99.0%
3. 성인 유증상자와 무증상자 전체 : 민감도 84.1% 특이도 99.6%
4. 18세 이하 청소년 중 무증상자 : 민감도 65.4% 특이도 99.0%
5. 성인 무증상자 : 민감도 70.2% 특이도 99.6%
6. 18세 이하 청소년 중 증상발현일이 7일 이내 : 민감도 84.6% 특이도 100%
7. 성인 중 증상발현일이 7일 이내 : 민감도 96.5% 특이도 100%
8. 18세 이하 청소년 중 증상발현일이 7일 이상 경과한 자 : 대상자 없음.
9. 성인 중 증상발현일이 7일 이상 경과한 자 : 민감도 66.7% 특이도 97.2%
결론적으로 현재까지 FDA에 등록된 엑세스바이오의 항원진단키트의 성능은 애보트사의 BinaxNow보다는 민감도에서 다소 떨어지는 결과가 도출됩니다. 특히 무증상자에 있어서는 50%대 VS 60%대 정도로 차이가 10% 이상 발생합니다.
엑세스바이오의 자가진단키트?
물론 현재 엑세스바이오가 준비중이라는 자가진단키트는 현재 승인받은 것과는 민감도를 높일 수 있는 다른 기술이 적용된 진단키트를 준비하고 있다고 하는데요.
관련 내용은 지난 7월에 아래 링크된 뉴스로 한국화학연구원이 개발한 코로나19바이러스 항원 신속진단 기술에 대한 기술이전에 대한 내용으로, 본 뉴스에서는 프리시젼바이오만 언급되었으나,
https://www.hankyung.com/it/article/202007305193i
임신 진단키트와 유사한 코로나19 신속 진단키트 개발
임신 진단키트와 유사한 코로나19 신속 진단키트 개발, 이해성 기자, 산업
www.hankyung.com
실제 과학기술정보통신부에서 배포한 보도자료를 보면, 해당 기술은 "CEVI"라 불리는 신종바이러스 융합연구단의 세부과제별 항목에서 진단 부분에서는 웰스바이오와 프리시젼바이오 2곳이 참여하였기 때문에 본 기술 역시, 엑세스바이오의 자회사인 웰스바이오로 이전되었다고 보는 것이 타당하다고 봅니다.

해당 진단기술은 아래 그림과 같이 기존 사람이 아닌 동물을 이용하여, 바이러스에 잘 결합하는 항체를 선별하고, 이를 나노입자에 링커시켜, 감염유무시 나타나는 발색효과를 극대화시키는 기술이라고 하는데요.
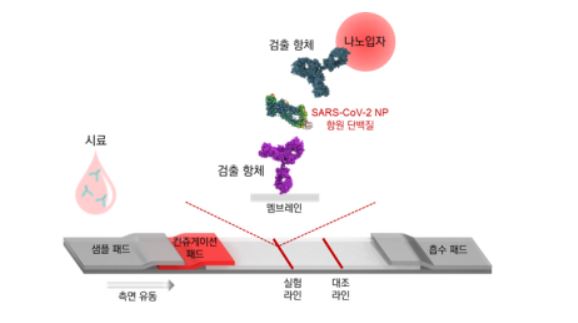
이전받은 신속진단기술에 대해서 올 3월 엑세스바이오의 최영호 대표이사의 인터뷰에서는 민감도가 경쟁사 대비 10배가량 높은 것으로 나오는 것을 파악된다라고 밝히기도 했습니다. 물론 개인적으로는 약간 회사 홍보성 기사 냄새가 많이 나긴 합니다.
https://signalm.sedaily.com/NewsView/22JWO22MJY/GX15
“2분기 중 코로나 홈테스트 승인기대…디지털 헬스케어 시장도 함께 열려”
미국 뉴저지에 본사를 둔 진단키트 전문회사 엑세스바이오(950130)의 최영호 대표이사가 2분기 중 식품의약국(FDA)의 신종 코로나바이러스 감염증(코로나19) 홈 진단키트 승인을 기대하고 있다고
signalm.sedaily.com
하지만 제가 여기저기 자료들을 찾아보니, 기존 진단키트 대비 민감도 10배 기술이 국내에 개발되긴 하였습니다.
본 기사는 2020년 11월에 나온 것으로 영남대 화학생화학부에서 종이 기반의 측방유동센서를 개발했다는 기사내용입니다.
영남대, 종이 기반 측방유동면역센서 개발
영남대학교는 김창섭 화학생화학부 교수 연구팀이 종이 기반의 측방유동면역센서(LFIA)를 개발했다고 17일 밝혔다. 측방유동면역센서는 표적물을 확인하는 바이오 검출장치로 임신진단키트가
www.etnews.com
기사에 따르면, 기존의 진단키트의 경우, 니트로셀룰로오스막에 항체를 무작위적으로 붙이기 때문에 검체가 이 부분을 통과할때 항체와 결합하는 결합력이 낮아질 수 있고, 이에 따라 민감도가 낮다고 하는데요. 이 기술의 경우엔, 항체 고정화 링커기술을 이용하여 셀롤로오스막에 항체를 배양성있게 고정시켜 민감도를 높였다고 합니다. 이를 통해 민감도가 기존 방식 대비 10배가 높아졌다고 기사에서는 소개하고 있습니다. 참고로 이 기술 연구는 과기부에서 지원한 수행과제입니다.
엑세스바이오가 이러한 민감도가 향상된 기술을 이전받아 상업생산화에 성공하였는지 여부는 따로 회사에서 언급하지 않아 확실히 알 수 없습니다. 하지만 일단 회사에서는 1분기 회사 보고서를 통해 코로나 자가진단키트에 대해서 미국 FDA의 긴급사용승인허가 진행 중이라고 밝혔으니, 승인 후, 성능평가서가 나오게 된다면 사실인지 아닌지 확인이 필요한 사안입니다.

이상으로 오늘은 엑세스바이오의 코로나바이러스 항원진단키트의 성능과 애보트사의 BinaxNow와의 성능비교, 그리고 자가진단키트 성공 가능성에 대해 살펴보았습니다. 물론 지금은 변이바이러스로 인해 다시금 진단키트 주들이 주식시장에서 재조명을 받고 있으나, 호흡기 감염 바이러스는 언젠가는 변이를 거치면서 치명률이 낮아진다는 점, 그리고 올 연말에는 경구용 치료제가 미국을 중심으로 전 세계에서 동시다발적으로 생산될 예정이라는 점등을 감안하여 볼 때 코로나를 통한 성장에는 분명히 한계가 있다고 보입니다.
특이 질병 진단을 통한 회사 외형성장보다는 회사가 보유한 바이오마커 및 진단기술을 활용한 원격의료시장으로 진출 및 플랫폼화의 관점으로 회사의 장기 성장전략을 분석하고 투자관점을 새롭게 설정해야 할 때가 아닌가 생각해봅니다.
글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'주식 투자' 카테고리의 다른 글
| 엑세스바이오 미국 K-12 학교 재개 프로그램에 신속진단키트공급중 By GINKGO BIOWORKS (0) | 2021.07.25 |
|---|---|
| 미국 친환경 회사 관련 주식 - ② 웨이스트 매니지먼트 (0) | 2021.07.24 |
| 미국 친환경 회사 관련 주식 - ① 캐네디언솔라 (0) | 2021.07.18 |
| 미국 주식 코로나 바이러스 진단 업체 - ⑥ 애보트래버라토리 (0) | 2021.07.17 |
| 미국 주식 코로나 바이러스 진단 업체 - ⑤ 퀴아젠 (0) | 2021.07.14 |







