
이전 글에서 이성분 이온 결합 화합물의 화학식과 명칭 붙이는 방법에 대해서 알아보았는데요.
2021.10.03 - [투자 아이디어] - 이성분 이온결합 화합물의 화학식과 명칭 붙이는 방법 - 1
이성분 이온결합 화합물의 화학식과 명칭 붙이는 방법 - 1
이성분 이온결합 화합물이란? 이성분 화합물(binary compound)이란 한개의 금속원소와 한개의 비금속 또는 두개의 비금속 원소로 이루어진 화합물을 지칭하는 말로, 이성분 이온결합 화합물(binary i
kairosm4628.tistory.com
두 가지 이상의 이온을 가진 금속 원소
이성분 이온 결합 화합물에서는 보통 각 원소당 1종류의 이온을 만들 수 있는데, 예외적으로 하나의 원소로부터 2가지 이상의 양이온이 형성되는 경우가 있습니다. 특히 전이 금속(원소)에서의 양이온으로써 많이 나타나고 있는데요. 이처럼 여러 가지의 전하를 가질 수 있는 금속을 '전위금속'이라고 부르기도 합니다.
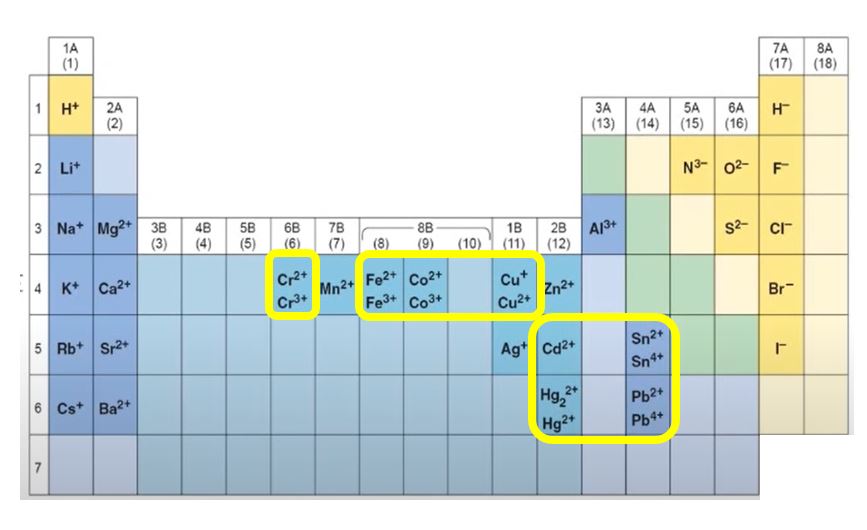
이렇게 전이 원소들은 두 가지 이상의 이온을 만들 수 있기 때문에 이들을 분류할 필요성이 있는데요. 보통 로마체계와 스토크 체계로 분류하여 사용합니다.
로마 체계의 화학식 표기법 :
양이온의 전하량에 따라서 Ⅰ,Ⅱ,Ⅲ,Ⅳ 등으로 금속이온의 이름 바로 다음에 괄호 안에 로마숫자로 이온의 전하를 표시합니다.
스토크 체계의 화학식 표기법 :
두 가지 이온 중, 전하가 작은 이온에는 접미사 '-ous'를 전하가 큰 이온에는 접미사 '-ic'를 붙입니다.
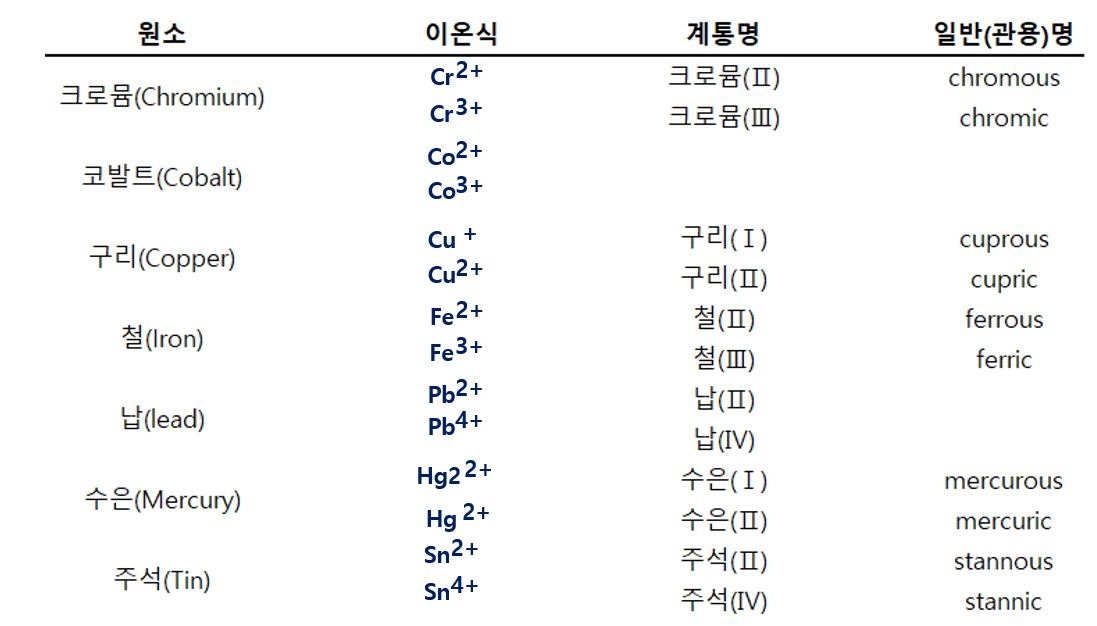
둘 이상의 일원자 이온을 만드는 금속의 화합물 화학식과 명명법
이러한 둘 이상의 이온을 만들어 내는 금속의 화합물의 화학식을 알기 위해서는 전하의 균형법칙을 이용하여, 음이온의 전하량을 먼저 알아낸 다음, 양이온의 전하량을 산출해야 합니다.
염화구리(CuCl)를 예로 들면, 위의 표에서 구리는 Cu+와 Cu2+ 두 가지 이온을 만들 수 있으므로, 먼저 음이온 성질을 띤 염소(Cl)의 전하량을 먼저 파악해야 합니다.
CuCl에서 음이온은 Cl이며 전하는 -1이므로 이온결합 화합물에서 전하가 균형을 이루는 원리를 이용하면 구리(Cu)는 양이온으로 전하는 +1로 구하게 됩니다.
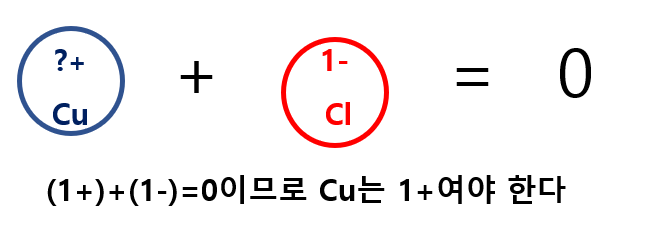
이름에는 금속 이온의 이름 바로 다음에 괄호 안에 로마 숫자로 이온의 전하를 표시하는데요. 염화구리에서의 구리는 전하 값이 +1이므로 로마 체계법에 따르면, 로마 숫자 'Ⅰ'를 쓰게 됩니다. 이와는 다르게 슈토크 체계로는 Cu+와 Cu2+ 두 가지 이온 중, 염화구리에서는 Cu+가 해당되므로 전하가 작은 이온에는 접미사 '-ous'를 붙이게 됩니다.
이렇게 되면, 그냥 염화구리라고 쓰는 것이 아닌, 로마 체계에서는 염화구리(Ⅰ)라 쓰게 되며 영문식으로는 [Copper (Ⅰ) Chloride]라 쓰게되며, 스토크 체계에서는 "Cuprous Chloride"로 사용하게 됩니다.

다른 예시로, 산화철(Fe2O3)을 예로 들면, 표에서 철은 Fe2+와 Fe3+ 두 가지 이온을 만들 수 있으므로, 먼저 음이온 성질을 띤 산소(O)의 전하량을 먼저 파악해야 합니다.
Fe2O3에서 음이온은 O이며 전하는 -2이며, 3개의 산소 음이온이 있기 때문에 전체 음이온의 전하량은 6개가 됩니다. 마찬가지로 이온결합 화합물에서 전하가 균형을 이루는 원리를 이용하면 철(Fe)의 개수가 2개이므로 양이온 전하량은 +3이 되어야 하므로 Fe2O3에서의 Fe의 양이온 전하량은 +3이 됩니다.
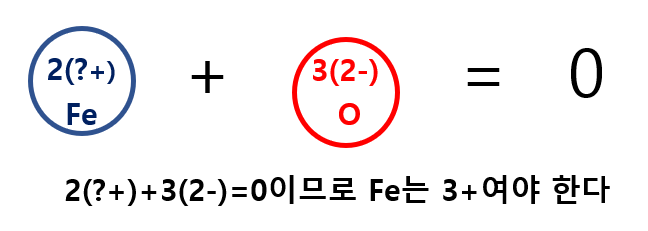
이렇게 되면, 그냥 산화철라고 쓰는 것이 아닌, 로마 체계에서는 산화철(Ⅲ)이라 쓰게 되며 영문식으로는 [Irion (Ⅲ) oxide]라 쓰게되며, 스토크 체계에서는 "ferric oxide"로 사용하게 됩니다.

글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'화학 공부' 카테고리의 다른 글
| 수화된 이온 결합 화합물 명명법 (0) | 2021.10.06 |
|---|---|
| 다원자 이온의 화학식과 산소산 음이온 명명법 (0) | 2021.10.04 |
| 이성분 이온결합 화합물의 화학식과 명칭 붙이는 방법 - 1 (0) | 2021.10.03 |
| 일반 화학 : 화학결합의 종류 - 공유결합 (0) | 2021.09.30 |
| 일반 화학 : 화학결합의 종류 - 이온결합 (0) | 2021.09.30 |







