앞 글에서 각각의 화합물의 구성 원소와 구성 배수를 알 수 있는 화학식에 대해서 정리해보았습니다.
2021.10.27 - [화학 공부] - 일반화학 : 화학식을 나타내는 방법
일반화학 : 화학식을 나타내는 방법
화학식을 나타내는 방법 화학식을 나타내는 방법은 아래와 같이 크게 4가지로 분류할 수 있습니다. 1. 실험식 : 화합물 내에 각 원소의 종류와 수를 가장 간단한 정수비로 나타내는 식 2. 분자식 :
kairosm4628.tistory.com

그럼에도 불구하고 똑같은 분자식을 가지고 있으면서도 서로 다른 화합물인 경우가 있는데, 이러한 화합물은 이성질체(Isomer)라고 불립니다.
즉, 이성질체란 분자식은 같지만, 화합물의 구성요소인 원자들이 서로 다른 배열로 결합하여 성질이 다른 화합물을 뜻합니다.
이성질체는 구조와 배열에 따라 크게 4가지로 구분하게 되는데요. 아래와 같이 총 4가지의 이성질체로 분류할 수 있습니다.
1) 구조 이성질체 : 가장 간단한 이성질 형태로, 원자들이 서로 다른 배열로 연결된 이성질체
2) 입체 이성질체 : 구조 이성질체를 제외한 다른 모든 이성질체를 포함하는 이성질체(아래 기하 이성질체와 광학 이성질체를 포함)
3) 기하 이성질체 : 분자식은 동일하지만, 결합의 회전이 제한되어 생겨난 이성질체
4) 광학 이성질체 : 분자식이 동일하며, 서로 거울 대칭인 관계로 이루어진 이성질체
구조 이성질체 예시를 통해 보는 이성질체의 특징
본 글에서는 이성질체에 대하여 간략하게 정리하는 글이기 때문에, 구조 이성질체를 예로 들어 정리하도록 하겠습니다.
앞에서 설명한대로, 구조 이성질체는 분자식은 동일하지만, 원자들 사이의 결합 형태가 상이하여, 몰 질량은 동일하지만 녹는점이나 밀도 등의 물리적 성질은 달라지게 됩니다.
대표적으로 예를 들 수 있는 화합물이 바로 에탄올과 다이에틸 에터입니다. 이 둘의 분자식은 C2H6O로 동일하며, 구성 원소들의 개수가 동일하므로, 몰 질량도 46.07 g/mol로 같습니다. 하지만 이 둘 간의 끓는점과 밀도, 그리고 구조식은 서로 다른데요.
이는 에탄올은 구조식에서도 알 수 있듯이 수산기(OH)라는 작용기를 지닌 유기화합물로써, 상온에서 액체상태로 존재하는 반면, 다이에틸 에터는 한 가운데 산소 원자를 중심으로 CH3- 2개가 결합된 형태이기 때문에 상온에서 기체 상태로 존재합니다.
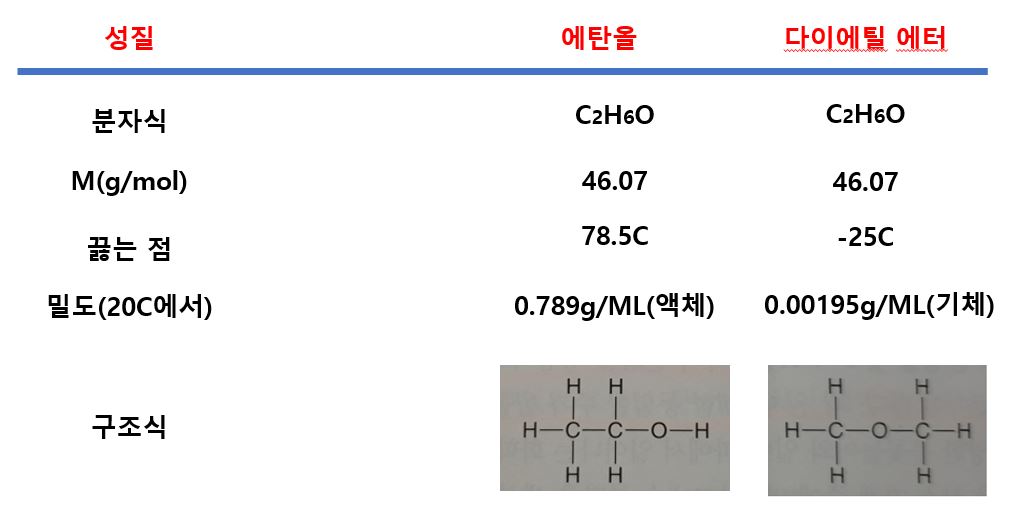
참고로, 원자의 수나 종류가 증가할수록 구조 이성질체의 종류(주어진 분자식으로 쓸 수 있는 구조식의 수)도 증가하게 되는데요. 예를들어 C2H6O는 2개, C3H8O는 3개, C4H10O는 7개의 이성질체를 가지고 있습니다.
글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'화학 공부' 카테고리의 다른 글
| 일반화학 : 반응물과 생성물의 양 계산하기 (0) | 2021.11.24 |
|---|---|
| 일반 화학 : 화학반응식 균형 맞추기 (0) | 2021.10.30 |
| 일반화학 : 화학식을 나타내는 방법 (0) | 2021.10.27 |
| 일반 화학 : 화합물에서의 질량 백분율(질량분율) 및 질량 계산 (0) | 2021.10.15 |
| 주어진 화합물에서의 화학 개체의 양 - 질량 - 개수 계산 (0) | 2021.10.13 |







