
균형 화학 반응식과 화학량론적인 당량 몰 비
균형 화학 반응식에서, 어느 한 물질의 양(mol)은 다른 물질의 양(mol)과 화학량론적으로 당량이다.
여기서 당량(equivalent)이란 일정한 양을 지닌 한 물질이 반응과 생성하는 과정에 있어 일정량의 다른 물질과 관련되어 반응하는 것을 뜻하는 것을 의미하며 이러한 물질들 사이의 정량적 관계는 화학량론적으로 당량 몰비(molar ratio)로 표현된다.
예시) 프로페인(C3H8) 1mol이 산소와 반응하여 연소되었을 때의 생성물에 대한 화학반응식은?

프로테인(C3H8)을 이용하여 반응을 정량적으로 살펴보면, 아래와 같이 정리할 수 있습니다.
1mol의 C3H8은 5mol의 O2와 반응한다
1mol의 C3H8은 3mol의 CO2를 만든다
1mol의 C3H8은 4mol의 H2O를 만든다
그러므로 이 반응에서 앞에서 언급한 화학량론적인 당량의 관계를 정리하면 아래와 같습니다.
1mol의 C3H8은 5mol의 O2와 화학량론적 당량이다.
1mol의 C3H8은 3mol의 CO2와 화학량론적 당량이다.
1mol의 C3H8은 4mol의 H2O와 화학량론적 당량이다.
화학량론적인 당량 관계를 이용한 생성물 질량 구하기
이러한 화학량론적인 당량 관계를 이용하여 생성물의 질량을 구할 수 있는데요.
가량 아래와 같이 예를 들면,
예시) 프로페인(C3H8) 11g이 산소와 연소반응을 하였을 때 발생하는 물(H2O)의 질량은 얼마인가?
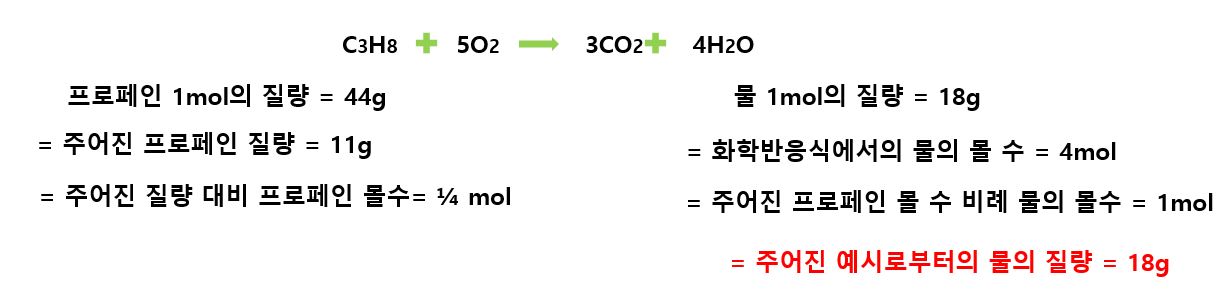
답 : 프로페인(C3H8) 1mol의 질량은 44g(C=12X3 + H=1X8)이므로 프로페인 11g은 1/4 mol로 환산할 수 있으며,
이때 생성물인 물(H2O)는 위의 화학반응식에서 프로페인 1mol당 4mol의 물이 생성되기 때문에 당량 몰비는 1:4가 된다.
그러므로 프로페인 1/4 mol에서 생성되는 물(H2O)은 1mol이며, 질량은 18g(H= 1X2 + O= 16X2)이 된다.
글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'화학 공부' 카테고리의 다른 글
| 일반 화학 : 화학반응식 균형 맞추기 (0) | 2021.10.30 |
|---|---|
| 일반 화학 : 이성질체 (0) | 2021.10.28 |
| 일반화학 : 화학식을 나타내는 방법 (0) | 2021.10.27 |
| 일반 화학 : 화합물에서의 질량 백분율(질량분율) 및 질량 계산 (0) | 2021.10.15 |
| 주어진 화합물에서의 화학 개체의 양 - 질량 - 개수 계산 (0) | 2021.10.13 |







