
원자의 이온 결합
이온 결합은 원자가 한 개 이상의 전자를 얻거나 잃을 때 생성되는 전하를 가진 입자인 이온으로 이루어져 있을 때 발생하는 원자의 화학적인 결합방식입니다.
보통 이온결합은 주로 금속과 비금속이 반응할 때 생성되는 결합 형태인데요. 일반적으로 금속 원자는 하나 이상의 전자를 잃고 양전하를 뗀 양이온(Cation)이 되며 비금속 원자는 금속원자가 잃어버린 전자를 받아들여 음전하를 띤 음이온(Anion)이 됩니다.
이렇듯 금속원자가 비금속 원자에게 전자를 전달하여 전자의 소유권이 바뀌어지게 되고, 이러한 결과로 양이온과 음이온은 서로 전기적인 힘으로 끌어당겨 이온 결합 화합물을 형성하게 됩니다.
이온결합물의 이해
가령 염화나트륨(염화소듐)을 쉬운 예로 들어보겠습니다.
염화나트륨은 염소 원자와 소듐 원자가 전자를 주고받아 화학적으로 결합하여 만들어진 화합물로써, 이온 결합에 있어 단 두 개의 원소로 이루어진 가장 간단한 형태의 이온 결합 화합물 형태인 이 성분 이온 결합 화합물(Binary ionic compound)입니다.
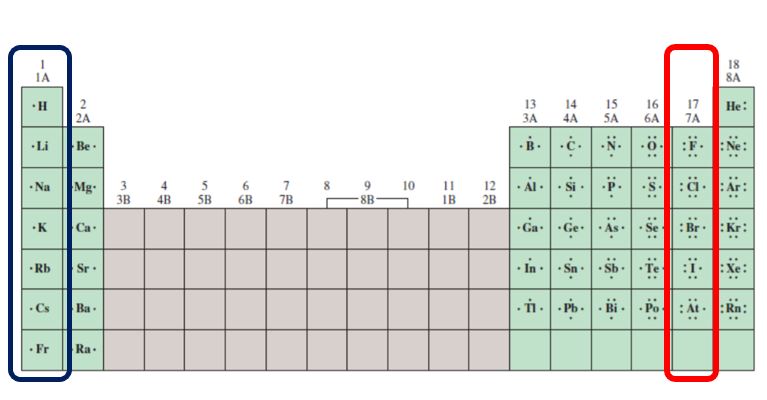
위의 사진은 원소 주기율표상에서 1(1A)족과 17(7A)족을 따로 표시한 것으로 각각의 원소기호 옆의 점은 전자의 개수를 루이스 점기호로 표시한 것입니다.
나트륨(소듐)원자는 주기율표상 1(1A)족에 속하는 대표적인 금속 원소입니다. 1족 원소는 일반적으로 최외각의 전자 개수가 1개이기 때문에, 스스로 안정화되는 물질이 되기 위해서 전자 1개를 버리는 것을 더욱 선호합니다
(반응성이 크다/ 이온화 경향이 크다)
이와는 반대로 염소 원자는 주기율표상 17(7A)족에 속하는 대표적인 비금속 원소입니다. 7A족 원소는 일반적으로 최외각 전자의 개수가 안정된 상태의 전자 개수보다 1개 부족하기 때문에 스스로 안정화되는 물질이 되기 위해서 전자 1개를 가져오는 것을 더욱 선호합니다. (반응성이 작다 / 이온화 경향이 작다)
이온결합을 유지시켜주는 힘, 정전기적 인력
이렇게 서로 전자를 주고받은 나트륨(소듐)과 염소 원자는 어떻게 이온 결합 상태를 유지할 수 있을까요?
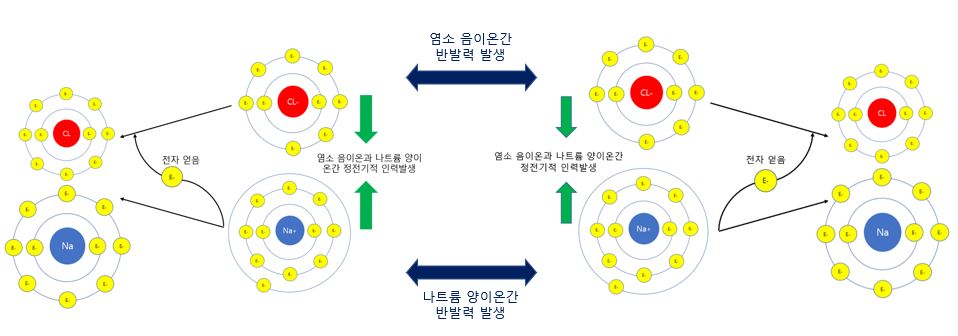
그것은 바로 전자를 주고 받는 과정에서 나트륨은 전자를 한 개 잃고 나트륨 양이온(Na+)이 되었고, 염소 원자는 전자를 얻어서 염화 이온(Cl-)이 되면서 같은 전하의 이온들(Na+와 Na+, Cl-와 Cl-)는 서로 밀어내면서 반대로 하전된 이온들 (Na+와 Cl-)는 서로 끌어당기는 정전기적 인력이 발생하였기 때문입니다.
글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'화학 공부' 카테고리의 다른 글
| 이성분 이온결합 화합물의 화학식과 명칭 붙이는 방법 - 1 (0) | 2021.10.03 |
|---|---|
| 일반 화학 : 화학결합의 종류 - 공유결합 (0) | 2021.09.30 |
| 기초 일반화학 : 원자핵의 발견(러더퍼드의 원자모형) (1) | 2021.09.28 |
| 기초 일반화학 : 음극선과 전자의 발견(톰슨의 원자모형) (0) | 2021.09.25 |
| 기초 일반화학 : 물질세계 개념 3 - 돌턴의 원자론 (0) | 2021.09.24 |







