
화합물에 대한 양-질량-수의 관계
화합물 내에 각 원소의 양(mol)을 구하는데 질량과, 수의 관계는 아래와 같이 정리할 수 있습니다.

1. 화합물의 특정 질량(X)이 주어지면, 먼저 화합물을 구성하고 있는 원자량의 합(몰 질량=M)을 구합니다.
만약 화합물의 특정 질량(X)이 가진 몰 질량을 구하고자 한다면,,
: 화합물의 특정 질량(X)을 몰 질량에 나눕니다.(X/M)
만약 화합물의 특정 질량(X)이 가진 화합물의 개수를 구하고자 한다면,
: 2번으로부터 구해진 특정 질량에서의 몰 질량에 아보가드로 수를 곱합니다.([X/M] * 6.022*10^23
화합물의 질량으로부터 양과 분자의 수 구하기 예시 - 1
예시 1) 이산화 질소(Nitrogen dioxide)는 자동차 배기가스로부터 생성되는 도시 스모그의 구성성분이다. 8.92g의 이산화질소에는 몇 개의 분자가 들어있는가?
A) 굵게 표시된 것처럼, 이산화질소(NO2)의 특정 질량(8.92g)이 주어졌으므로 아래 로드맵에 따라 계산할 수 있습니다.
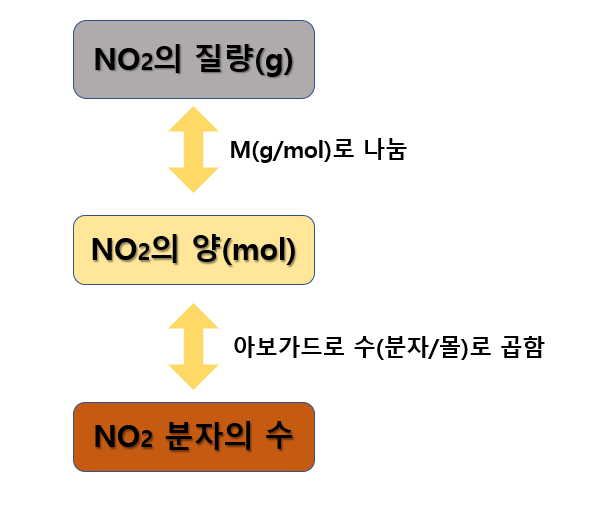
먼저 이산화질소(NO2)의 몰 질량(M)을 구해야합니다.
M=(질소원자의 개수 X 질소 원자의 몰 질량) + (산소원자의 개수 X 산소원자의 몰질량)
M=(1 X 14.01g/mol) + (2 X 16.00 g/mol) = 46.01g/mol
이산화질소(NO2) 질량(g)으로부터의 양(mol)은 아래와 같이 계산됩니다.
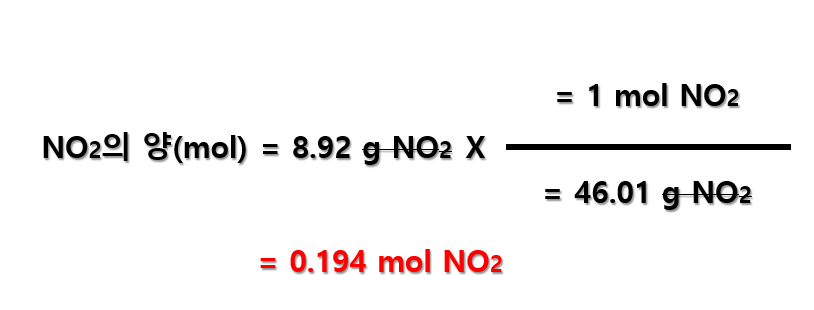
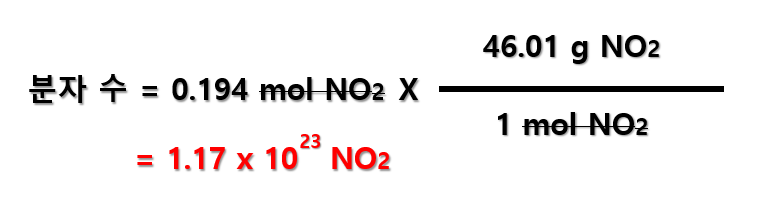
마찬가지로, NO2의 양(mol)으로부터 분자 수를 환산하게 된다면, 아래와 같이 계산할 수 있습니다.
화합물의 질량으로부터 양과 분자의 수 구하기 예시 - 2
예시 2) 탄산암모늄은 흰색 고체로 가열하면 분해된다. 여러 용도 중에서 베이킹파우더, 소화기 및 탈취제 등의 성분으로 많이 쓰인다.
a) 탄산암모늄 41.6g에는 화학식 단위가 얼마나 있는가?
b) 이 시료 안에 산소 원자(O)는 얼마나 들어있는가?
A) 답을 구하기 위한 로드맵을 짜기 이전에 탄산암모늄의 화학식을 구해야 하는데요. 이전 글에서 소개한 다원자 이온 설명에서 우리는 암모늄은 1개의 양이온을 가지고 있으며(NH+), 탄산은 2개의 음이온을 지니고 있음(CO3^2-)을 알고 있습니다.
2021.10.04 - [화학 공부] - 다원자 이온의 화학식과 산소산 음이온 명명법
다원자 이온의 화학식과 산소산 음이온 명명법
다원자 이온이란 다원자 이온이란 둘 이상의 원자들이 공유 결합하여 하나의 이온처럼 알짜 양전하 혹은 음전하를 가지는 이온을 뜻합니다. 좀더 부연하자면, 다원자 이온은 둘 이상의 강하
kairosm4628.tistory.com
1) 암모늄 양이온과 탄산 음이온이 이온 결합 화합물로써, 균형을 맞추려면 암모늄 양이온의 개수가 2개가 되어야 하므로, 탄산암모늄의 전체 화학식은 아래와 같이 정리할 수 있습니다.

예시 1과 마찬가지로 탄산암모늄[(NH4)2CO3]의 특정 질량(41.6g)이 주어졌으므로 아래 로드맵에 따라 계산할 수 있습니다.
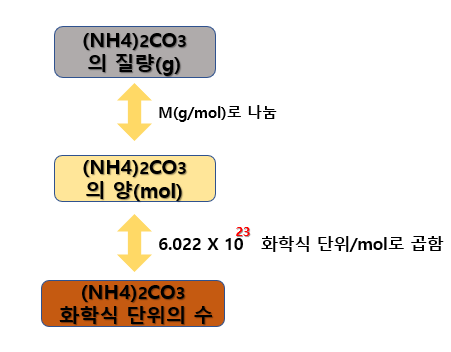
먼저 탄산암모늄[(NH4)2CO3]의 몰 질량(M)을 구해야 합니다.
a) 탄산암모늄 41.6g에는 화학식 단위가 얼마나 있는가?
M=(질소 원자의 개수 X 질소 원자의 몰 질량) + (수소 원자의 개수 X 수소 원자의 몰질량) +(탄소 원자의 개수 X 탄소 원자의 몰질량) + (산소 원자의 개수 X 산소 원자의 몰질량)
M=(2 X 14.01g/mol N) + (8 X 1.008 g/mol H) + (1 X 12.01 g/mol C) + (3 X 16.00 g/mol O)= 96.09 g/mol (NH4)2CO3
탄산암모늄[(NH4)2CO3]의 질량(g)으로부터의 양(mol)은 아래와 같이 계산됩니다.

마찬가지로, 질산암모늄(NH4)2CO3의 양(mol)으로부터 화학식 단위를 환산하게 된다면, 아래와 같이 계산할 수 있습니다.

b) 이 시료 안에 산소 원자(O)는 얼마나 들어있는가?

글봐주셔서 고맙습니다.
구독,좋아요
한 번씩만 눌러주시면 저에게 큰힘이 되겠습니다.
(비로그인도 구독,좋아요됩니다~ 마음껏 눌러주세요)

'화학 공부' 카테고리의 다른 글
| 일반화학 : 화학식을 나타내는 방법 (0) | 2021.10.27 |
|---|---|
| 일반 화학 : 화합물에서의 질량 백분율(질량분율) 및 질량 계산 (0) | 2021.10.15 |
| 물질의 양(mol)과 질량(g), 수의 환산 (0) | 2021.10.11 |
| 몰과 질량 (0) | 2021.10.10 |
| 일반 화학 : 몰(Mole)이란 (0) | 2021.10.08 |







