
Unadjuvanted intranasal spike vaccine elicits protective mucosal immunity against sarbecoviruses(비강 내 스파이크 백신은 사르베코 바이러스에 대한 보호 점막 면역을 유도합니다.)
Abstract
The SARS-CoV2 pandemic has highlighted the need for vaccines that not only prevent disease, but also prevent transmission. Parenteral vaccines induce robust systemic immunity, but poor immunity at the respiratory mucosa. Here we describe the development of a vaccine strategy we term “prime and spike” that leverages existing immunity generated by primary vaccination (prime) to elicit mucosal immune memory within the respiratory tract using unadjuvanted intranasal spike boosters (spike). We show that prime and spike induces robust resident memory B and T cell responses, IgA at the respiratory mucosa, boosts systemic immunity, and completely protects mice with partial immunity from lethal SARS-CoV-2 infection. Using divergent spike proteins, prime and spike enables induction of cross-reactive immunity against sarbecoviruses.
SARS-CoV-2 팬데믹은 질병을 예방할 뿐만 아니라 전염을 막는 백신의 필요성을 강조했습니다. 비경구 백신은 강력한 전신 면역력을 유도하지만 호흡기 점막에서는 면역력이 떨어집니다. 여기서는 1차 백신(프라임)에 의해 생성된 기존 면역력을 활용하여 비강내 스파이크 부스터(스파이크)를 사용하여 호흡기 내에서 점막 면역 기억을 유도하는 "프라임 앤 스파이크" 백신 전략의 개발에 대해 설명합니다. 우리는 프라임과 스파이크가 강력한 상주 기억 B와 T 세포 반응을 유도하고, 호흡 점막의 IgA가 전신 면역력을 높이고, 치명적인 SARS-CoV-2 감염으로부터 부분 면역력을 완전히 보호한다는 것을 보여줍니다. 발산 스파이크 단백질을 사용하여 프라임 및 스파이크는 사르베코 바이러스에 대한 교차 반응 면역의 유도를 가능하게 합니다.
During the past 2 years of the SARS-CoV2 pandemic, there has been an unprecedented development of highly effective vaccines, utilizing technologies including modified mRNA encapsulated in lipid nanoparticles (LNP) and replication-deficient adenoviral vectors. Phase 3 clinical trials and subsequent post-marketing vaccine effectiveness studies initially showed >90% vaccine efficacy against symptomatic disease (1–3). Additionally, early transmission studies showed decreased rates of transmission in household members of vaccinated individuals (4, 5). Unfortunately, recent studies have demonstrated decreasing vaccine effectiveness, starting 4 months following a second dose with mRNA-LNP–based regimens and earlier with other vaccines (6, 7). Furthermore, continued viral evolution with increasing immune evasive variants of concern (VOC), most recently Omicron (B.1.529) and its sublineages, has also contributed to decreased vaccine effectiveness (8–10). With enhanced immune evasion and waning systemic immunity, current vaccines have become less effective at preventing viral transmission, which is likely worsened by increased viral transmissibility, and their poor induction of mucosal immunity (11).
SARS-CoV-2 대유행의 지난 2년 동안 지질 나노입자(LNP)에 캡슐화된 변형 mRNA와 복제 결핍 아데노바이러스 벡터를 포함한 기술을 활용하여 매우 효과적인 백신의 개발이 전례 없이 이루어졌습니다. 임상 3상 및 후속 시판 후 백신 효과 연구는 처음에 증상 질환에 대한 백신 효능이 90% 이상(1-3)으로 나타났습니다. 또한, 초기 전염 연구 결과, 예방접종을 받은 개인(4, 5)의 가구원 감염률이 감소했습니다. 불행히도, 최근 연구는 mRNA-LNP 기반 요법을 사용한 두 번째 투여 후 4개월 후에 시작하여 다른 백신(6,7)을 사용한 이전부터 백신 효과가 감소하는 것을 보여주었습니다. 또한, 면역 회피성 우려 변종(VOC)이 증가함에 따라 바이러스 진화가 계속되면서, 가장 최근에는 Omicron (B.1.529)과 그 하위 계통도 백신 효과 감소에 기여했습니다(8–10). 면역 회피가 강화되고 전신 면역이 약해지면서, 현재 백신들은 바이러스 전염성의 증가와 점막 면역의 나쁜 유도로 인해 악화될 가능성이 있는 바이러스 전염을 예방하는 데 덜 효과적이 되었습니다 (11).
Currently approved SARS-CoV2 vaccines rely on intramuscular (IM) administration, which induces high levels of circulating antibodies, memory B cells, and circulating effector CD4+ and CD8+ T cells in animal models and humans (12–14). However, parenteral vaccines do not induce high levels of potent antiviral immune memory at sites of infection, such as tissue-resident memory B (BRM) cells and T (TRM) cells as well as mucosal IgG and dimeric IgA (15–17). This contrasts with infection in humans and mice, where CD8+ TRM and mucosal IgA are robustly induced (15, 18). Vaccines targeting the respiratory mucosa could address the shortcomings of parenteral vaccination, as recent assessments of intranasally delivered SARS-CoV-2 spike encoding adenoviral vectors have shown mucosal immunogenicity as well as protection and reduced viral shedding in mice, hamsters, and nonhuman primates (19–23).
현재 승인된 SARS-CoV-2 백신은 동물 모델과 사람(12–14)에서 높은 수준의 순환 항체, 기억 B 세포 및 순환 효과기 CD4+ 및 CD8+ T 세포를 유도하는 근육 내(IM) 투여에 의존합니다. 그러나 비경구 백신은 점막 IgG 및 이량체 IgA(15–17)뿐만 아니라 조직 상주 기억 B(BRM) 세포 및 TRM 세포와 같은 감염 부위에서 높은 수준의 강력한 항바이러스 면역 기억을 유도하지 않습니다. 이는 CD8+ TRM과 점막 IgA가 강하게 유도되는 인간과 생쥐의 감염과 대조됩니다(15, 18). 아데노바이러스 벡터를 암호화하는 사스-CoV-2 스파이크의 최근 평가가 마우스, 햄스터 및 비인간 영장류(19–23)에서 보호와 바이러스 유출 감소뿐만 아니라 점막 면역성을 보여주었기 때문에 호흡기 점막을 대상으로 한 백신은 비경구 예방 접종의 단점을 해결할 수 있습니다.
Although primary respiratory administration of vaccines induces mucosal immunity, systemic priming followed by intranasal (IN) boosting results in similar systemic immunity to systemic prime–boost regimens, but with enhanced mucosal immunity (2426). Most examples of recombinant subunit vaccines administered either systemically or IN are co-formulated with adjuvants to enhance immunogenicity. However, administration of vaccines to the respiratory tract in humans has proven difficult. There have been cases of IN adjuvanted inactivated vaccine for seasonal influenza leading to Bell’s palsy, possibly caused by the specific toxin adjuvant mediating inflammation of neurons (27).
백신의 일차 호흡 투여는 점막 면역력을 유도하지만, 전신 프라이밍에 이어 인트라나살(IN) 부스팅은 전신 프라임-부스트 요법과 유사한 전신 면역력을 가져오지만, 점막 면역력은 강화됩니다(24–26). 계통적으로 또는 IN으로 투여되는 재조합 서브유닛 백신의 대부분의 예는 면역원성을 향상시키기 위해 보조제와 함께 공배합됩니다. 하지만, 사람의 호흡기에 백신을 투여하는 것은 어려운 것으로 밝혀졌습니다. 계절성 인플루엔자에 대한 인부당 불활성화 백신이 벨의 마비로 이어지는 사례가 있었는데, 이는 뉴런(27)의 염증을 매개하는 특정 독소 보조제에 의한 것일 수 있습니다.
In the setting of non-protective immunity from parenteral vaccination regimens, we assessed the immunogenicity and protection afforded by IN boosting with SARS-CoV-2 spike. Here, we describe a vaccination strategy that utilizes systemic priming with mRNA-LNP followed by IN boosting with either unadjuvanted spike proteins or an immunosilent polyplex encapsulating spike mRNA.
비경구 예방 접종 요법의 비보호 면역 설정에서, 우리는 SARS-CoV-2 스파이크로 IN 부스팅이 제공하는 면역원성과 보호를 평가했습니다. 여기서, 우리는 mRNA-LNP를 사용한 시스템 프라이밍을 이용한 백신 접종 전략을 설명한 후, 비보조 스파이크 단백질 또는 mRNA를 캡슐화하는 면역 사일런트 폴리플렉스를 사용한 IN 부스팅을 사용합니다.
Results(결과)
Intranasal boosting with unadjuvanted SARS-CoV-2 spike induces mucosal humoral immunity.
사스-CoV-2 스파이크를 이용한 비강 내 부스팅은 점막 체액 면역력을 유도합니다.
To assess the potential of IN unadjuvanted subunit vaccine boosting for the development of respiratory mucosal immunity, we decided to harness the strong systemic immunogenicity of mRNA-LNP. We additionally benefited from extensive SARS-CoV2 spike engineering by using HexaPro, which has been shown to significantly enhance immunogenicity and increase protein stability (28).
호흡기 점막 면역력 개발을 위한 IN 비보조 서브유닛 백신 부스팅의 잠재력을 평가하기 위해 mRNA-LNP의 강력한 전신 면역원성을 활용하기로 결정했습니다. 우리는 면역원성을 크게 향상시키고 단백질 안정성을 높이는 것으로 나타난 HexaPro를 사용하여 광범위한 SARS-CoV-2 스파이크 엔지니어링의 혜택을 추가로 받았습니다(28).
We vaccinated K18-hACE2 (mice) with mRNA-LNP (Pfizer/BioNTech BNT162b2) by IM injection (prime), followed 14 days later by IN administration of recombinant unadjuvanted spike protein (prime and spike (P&S)). Mice were euthanized at days 21 or 28 and assessed for mucosal humoral immunity (Fig. 1A).
K18-hACE2(쥐)에 mRNA-LNP(화이자/바이오) 백신을 접종했습니다.IM 주입(프라임)에 의한 NTech BNT162b2)에 이어 14일 후 재조합 비증강 스파이크 단백질(프라임 및 스파이크(P&S))의 IN 투여가 이어졌습니다. 생쥐는 21일 또는 28일에 안락사되었고 점막 체액 면역에 대해 평가되었습니다(그림 1A).

First, we assessed anti-SARS-CoV2 spike IgG and IgA in nasal wash (Fig. 1, B and C), bronchoalveolar lavage fluid (BALF) (Fig. 1, D and E), and serum (Fig. 1, F and G). Only mice that received P&S developed high levels of anti-SARS-CoV-2 IgA and IgG in the nasal wash and BALF. Neither IM prime nor IN spike alone was sufficient to develop mucosal antibodies. In the serum, prime alone was sufficient to induce low levels of IgA and IgG. By contrast, P&S led to significant systemic boosting of both anti-spike IgA and IgG. These increases in antibody levels correlated with increases in neutralization titers both in BALF (Fig. 1H) and serum (Fig. 1I). Thus, a single-dose unadjuvanted intranasal spike alone is not immunogenic and the induction of a potent mucosal and systemic antibody response by unadjuvanted spike requires prior systemic priming, in this case by mRNA-LNP.
먼저, 비강 세척(그림 1, B 및 C), 기관지 폐포 세척액(BALF)(그림 1, D 및 E), 혈청(그림 1, F 및 G)에서 항SARS-CoV-2 스파이크 IgG 및 IgA를 평가했습니다. P&S를 받은 쥐들만이 코 세척과 BALF에서 높은 수준의 항SARS-CoV-2 IgA와 IgG를 보였습니다. IM 프라임이나 IN 스파이크만으로는 점막 항체를 발달시키기에 충분하지 않았습니다. 혈청에서는 프라임만으로도 IgA와 IgG의 낮은 수준을 유도하기에 충분했습니다. 대조적으로, P&S는 안티스파이크 IgA와 IgG의 상당한 시스템 부양을 이끌었습니다. 이러한 항체 수준의 증가는 BALF(그림 1H)와 혈청(그림 1I)에서 모두 중화 역가의 증가와 상관관계가 있습니다. 따라서, 1회 투여량의 비강내 스파이크만으로는 면역원인이 아니며, 비강내 스파이크에 의한 강력한 점막 및 전신 항체 반응의 유도에는 mRNA-LNP에 의한 사전 전신 프라이밍이 필요합니다.
BRM cells in the lungs assist in rapid recall response of antibody-secreting plasma cells upon secondary heterologous challenge in influenza models and may be an important local immune effector in protecting against SARS-CoV-2 (29). Using intravenous (IV) CD45 labeling to differentiate circulating immune cells within lung tissue combined with B cell tetramers specific for the receptor binding domain (RBD) of the spike protein, we found that P&S leads to increased antigen-specific B cells within lung tissue (IV-CD45−B220+CD19+tetramer+) (Fig. 1J). We also examined the polyclonal tissue response, which likely represents a more complete set of spike-specific B cells within the lungs. We found increases in class-switched antibody-secreting cells (ASC) (IV-CD45−CD19+/−CD138+) in lung tissue expressing IgA or IgG (Fig. 1, K and L), and we found increased class-switched BRM cells (IV-CD45−B220+CD19+IgD−IgM−CD38+) expressing IgA or IgG (Fig. 1, M and N). Thus, P&S elicits local B cell responses in the lung.
폐의 BRM 세포는 인플루엔자 모델에서 2차 이질적 도전에 대해 항체를 분비하는 혈장 세포의 신속한 리콜 반응을 돕고 SARS-CoV-2(29)로부터 보호하는 데 중요한 국소 면역 효과자가 될 수 있습니다. 스파이크 단백질의 수용체 결합 도메인(RBD)에 특이적인 B 세포 테트라머와 결합된 폐 조직 내에서 순환 면역 세포를 구별하기 위해 정맥 (IV) CD45 라벨링을 사용하여 P&S가 폐 조직 내에서 항원 특이 B 세포(IV-CD45-B220+CD19+테트라머+)(그림 1J)로 이어진다는 것을 발견했습니다. 우리는 또한 폐 안에 있는 스파이크 특이적 B 세포의 더 완전한 세트를 나타내는 폴리클론 조직 반응을 조사했습니다. IgA 또는 IgG(그림 1, K 및 L)를 발현하는 폐조직에서 클래스 교환 항체 분비 세포(ASC) (IV-CD45-CD19+/-CD138+)가 증가하였고 클래스 교환 BRM 세포(IV-CD45-B220+CD19+IgD-)가 증가하였습니다.IgM-CD38+)는 IgA 또는 IgG를 나타냅니다(그림 1, M 및 N). 따라서, P&S는 폐에서 국소 B 세포 반응을 유도합니다.
Prime and Spike induces mucosal T cell immunity.
(프라임과 스파이크는 점막 T세포 면역력을 유도합니다.)
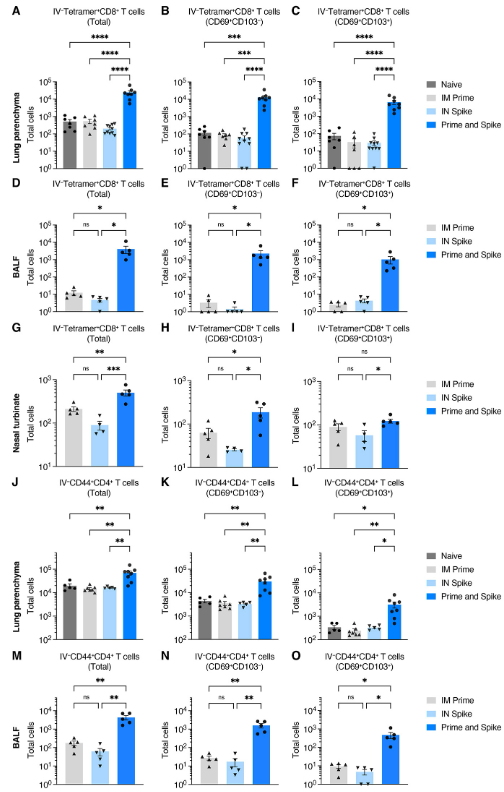
Given that P&S induced respiratory mucosal humoral memory, we next assessed the induction of lung TRM cells. Although adjuvant-free subunit vaccines have not traditionally been potent inducers of antigen-specific T cell responses, we hypothesized that the immune memory generated by mRNA-LNP priming would enable subunit-mediated T cell-boosting responses. To identify spike-specific CD8+ T cells, we utilized major histocompatibility complex (MHC) class I tetramer S539-546 (VNFNFNGL). There was a significant induction of IV-CD45−tetramer+ CD8+ T cells, which expressed canonical markers of TRM cells including CD69+ and CD103+, within lung tissue (Fig. 2, A to C), BALF (Fig. 2, D to F), and the nasal turbinate (Fig. 2, G to I). Moreover, there were significant increases in antigen-experienced CD4+ T cells (IV-CD45−CD44+CD4+), many of which also expressed CD69+ and CD103+ both within lung tissue (Fig. 2, J to L) and in the BALF (Fig. 2, M to O). Thus, P&S recruits expansion of lung parenchyma and airway CD8+ TRM and CD4+ TRM cells.
P&S가 호흡기 점막 체액기억을 유도한다는 점을 고려하여 다음으로 폐 TRM 세포의 유도를 평가했습니다. 보조제가 없는 서브유닛 백신은 전통적으로 항원 특이적 T세포 반응의 강력한 유도자가 아니었지만, 우리는 mRNA-LNP 프라이밍에 의해 생성된 면역 메모리가 서브유닛 매개 T세포 증가 반응을 가능하게 할 것이라는 가설을 세웠습니다. 스파이크 특이 CD8+ T세포를 식별하기 위해 주요 조직 적합성 복합체(MHC) 클래스 I 테트라머 S539-546(VNFNFNGL)을 사용했습니다. 폐 조직(그림 2, A ~ C), BALF(그림 2, D ~ F), 비강 터브네이트(그림 2, G ~ I) 내에서 CD69+와 CD103+를 포함한 TRM 세포의 표준 마커를 발현한 IV-CD45-테트라머+ CD8+ T 세포의 유의미한 유도가 있었습니다. 또한 항원 경험 CD4+ T 세포(IV-CD45-CD44+CD4+)에서 유의미한 증가가 있었으며, 이들 중 다수는 폐 조직(그림 2, J~L)과 BALF(그림 2, M~O)에서 모두 CD69+와 CD103+를 발현하였습니다. 따라서 P&S는 폐실질과 기도 CD8+ TRM 및 CD4+ TRM 세포의 확장을 모집합니다.
Host genotype, boosting interval, and intranasal volume have little effect on Prime and Spike.(숙주 유전자형, 상승 간격 및 비강 내 볼륨은 프라임 및 스파이크에 거의 영향을 미치지 않습니다.)
To assess whether mouse genotype, boosting interval, or boosting volume affected immunity induced by P&S, we compared mucosal CD8+ T cell and antibody responses following P&S under varying conditions including in K18-hACE2 versus C57B6/J (B6J) mice, 2-week versus 4-week boosting intervals, and 25-μl versus 50-μl intranasal inoculations (fig. S1A). Antigen-specific lung CD8+ TRM cells (fig. S1, B to D), BALF IgA and IgG (fig. S1, E and F), serum IgA and IgG (fig. S1, G and H), and serum neutralizing responses (fig. S1I) were similar among all groups and significantly higher than responses elicited by prime alone. These results support the robustness of P&S as multiple experimental variables can be modified without affecting overall immune responses.
마우스 유전자형, 증가 간격 또는 증가량이 P&S에 의해 유도된 면역력에 영향을 미치는지 평가하기 위해, 우리는 K18-hACE2 대 C57B6/J(B6J) 마우스, 2주 대 4주 증가 간격, 25-μl 대 50μl 내 접종(그림 1A)을 포함한 다양한 조건에서 점막 CD8+T 세포와 항체 반응을 비교했습니다. 항원 특이 폐 CD8+ TRM 세포(그림 S1, B~D), BALF IgA 및 IgG(그림 S1, E 및 F), 혈청 IgA 및 IgG(그림 S1, G 및 H), 혈청 중화 반응(그림 S1I)은 모든 집단에서 유사하며 프라임 반응만으로 유도된 것보다 유의하게 높았습니다. 이러한 결과는 전반적인 면역 반응에 영향을 미치지 않고 여러 실험 변수를 수정할 수 있기 때문에 P&S의 견고성을 지원합니다.
Delayed-interval Prime and Spike induces mucosal immunity.(지연 간격 프라임과 스파이크는 점막 면역력을 유도합니다.)
We wondered whether boosting at an increased interval would affect P&S responses. To test this, mice received IM mRNA-LNP and were boosted with IN spike 84 days later. Humoral and cellular mucosal immune responses on days 91 and 140 were sampled (fig. S2A). Delayed P&S was sufficient to induce CD8+ TRM cells for at least 56 days (fig. S2, B to D). Polyclonal CD4+ TRM cells were induced early at 7 days post boost. However, their numbers appeared to wane by 56 days (fig. S2, E to G). Delayed P&S also resulted in enhanced mucosal IgA and IgG in BALF (fig. S2, H and I), and serum IgA and IgG (fig. S2, J and K) at 56 days post boost. Thus, P&S administered even up to 3 months after priming elicits durable mucosal humoral and cellular immune responses.
우리는 증가된 간격의 부스팅이 P&S 반응에 영향을 미칠지 궁금했습니다. 이것을 테스트하기 위해, 쥐들은 IM mRNA-LNP를 받았고 84일 후에 IN 스파이크로 상승했습니다. 91일과 140일의 체액 및 세포 점막 면역 반응이 샘플링되었습니다(그림 S2A). 지연된 P&S는 CD8+ TRM 세포를 최소 56일 동안 유도하기에 충분했습니다(그림 S2, B ~ D). 폴리클론 CD4+ TRM 세포는 부스트 7일 후에 조기에 유도되었습니다. 그러나, 그들의 숫자는 56일만큼 감소하는 것으로 보였습니다 (그림 S2, E에서 G). 지연된 P&S는 또한 BALF(그림 S2, H 및 I)에서 점막 IgA 및 IgG를 증가시켰고, 혈청 IgA 및 IgG(그림 S2, J 및 K)는 부스트 56일 후에 증가했습니다. 따라서 P&S는 프라이밍 후 최대 3개월까지 점막 체액 및 세포 면역 반응을 지속시킵니다.
Intranasal delivery of mRNA polyplexes also mediates mucosal boosting.(mRNA 폴리플렉스의 비강 내 전달은 또한 점막 증강을 매개합니다.)
Poly(amine-co-ester)s (PACE) are biodegradable terpolymers that have been developed to encapsulate and deliver nucleic acids such as mRNA to specified tissues in vivo (30). Recent studies have shown that mRNA-LNP delivered to the respiratory tract is lethal in a dose-dependent manner in mice (31). By contrast, PACE materials have been developed to be relatively immunologically silent, enabling administration to locations more susceptible to immunopathology such as the respiratory tract. Chemically modifying PACE with polyethylene glycol dramatically improves in vivo lung delivery (32). To assess the utility of PACE encapsulating mRNA encoding spike protein as an IN booster, mRNA was extracted from BNT162b2 and encapsulated in PACE. Mice were primed IM with mRNA-LNP and boosted with IN spike mRNA encapsulated in PACE (PACE-spike). Additional control groups included PACE-spike only and IM prime + extracted mRNA (naked mRNA) (fig. S3A). Similar to what we found with P&S, prime and PACE-spike induced antigen-specific CD8+ TRM cells (IV-CD45−tetramer+CD69+CD103+) (fig. S3, B to D). Additionally, PACE-spike-boosted mice developed high levels of BALF IgA. Levels of BALF IgG and serum IgA and IgG were similar to IM prime alone (fig. S3, E to H). IM prime followed by IN naked mRNA was unable to induce mucosal or systemic immune responses above that of IM prime alone indicating that mRNA encapsulation by PACE was required for mucosal boosting. Additionally, a single dose of IN PACE-spike alone was insufficient to elicit any detectable mucosal or systemic antibody response at this dose.
폴리(아민-코-에스테르)는 mRNA와 같은 핵산을 캡슐화하고 생체 내 특정 조직에 전달하기 위해 개발된 생분해성 테르폴리머입니다(30). 최근 연구에 따르면 호흡기로 전달된 mRNA-LNP는 마우스(31)에서 용량 의존적인 방식으로 치명적입니다. 대조적으로, PACE 물질은 상대적으로 면역학적으로 조용하도록 개발되어 호흡기와 같은 면역 병리학에 더 취약한 위치에 투여할 수 있습니다. 폴리에틸렌 글리콜로 PACE를 화학적으로 수정하면 체내 폐 전달이 획기적으로 개선됩니다(32). 스파이크 단백질을 IN 부스터로 인코딩하는 mRNA를 캡슐화하는 PACE의 유용성을 평가하기 위해, mRNA를 BNT162b2에서 추출하여 PACE로 캡슐화했습니다. 생쥐는 mRNA-LNP로 IM을 프라이밍하고 PACE(PACE-spike)로 캡슐화된 INspike mRNA로 상승했습니다. 추가 대조군 그룹에는 PACE-spike만 포함되었고 IM prime + 추출된 mRNA(나체 mRNA)가 포함되었습니다(그림 S3A). P&S에서 발견한 것과 유사하게 프라임 및 PACE 스파이크 유도 항원 특이적 CD8+ TRM 세포(IV-CD45-테트라머+)입니다.CD69+CD103+)(그림 S3, B ~ D). 게다가, PACE-spike로 부푼 쥐들은 높은 수준의 BALF IgA를 개발했습니다. BALF IgG와 혈청 IgA 및 IgG의 수치는 IM 프라임 단독과 유사했습니다(그림 S3, E ~ H). IM prime과 IN naked mRNA는 점막 증강을 위해 PACE에 의한 mRNA 캡슐화가 필요하다는 것을 나타내는 IM prime 이상의 점막 또는 전신 면역 반응을 유도할 수 없었습니다. 또한, INPACE-spike의 단일 용량만으로는 이 용량에서 검출 가능한 점막 또는 전신 항체 반응을 이끌어내기에 충분하지 않았습니다.
Intranasal Spike or IN PACE-Spike boosts suboptimal Prime to protect against lethal SARS-CoV-2 challenge.(비강 내 스파이크 또는 IN PACE-Spike는 치명적인 SARS-CoV-2 도전에 대비하여 차선의 프라임을 강화합니다.)
Although current vaccines were initially extremely effective at eliciting protective immunity, waning antibody levels and immune evasion will necessitate boosters for the foreseeable future. The best approach to boosting remains an open question. To test whether IN administration would provide an alternative protective boost, we utilized a low-dose (LD) 0.05 μg of mRNA-LNP vaccine to mimic non-protective immunity. We have previously shown that this dose is insufficient to protect from SARS-CoV-2 challenge despite inducing systemic antibody responses (15). Mice primed with LD mRNA-LNP IM and boosted with IN spike developed antigen-specific lung CD8+ TRM cells and IgA and IgG in the BALF at 42 days post boost (fig. S4). Thus, low levels of immune memory allow for effective mucosal boosting of humoral and cellular responses by unadjuvanted IN spike.
비록 현재의 백신이 처음에는 보호 면역력을 유도하는 데 매우 효과적이었지만, 항체 수치의 감소와 면역 회피는 가까운 미래에 촉진제를 필요로 할 것입니다. 부양을 위한 최선의 접근 방식은 여전히 미해결 질문으로 남아 있습니다. IN 투여가 대체적인 보호 부스트를 제공할지 여부를 테스트하기 위해, 우리는 비보호 면역성을 모방하기 위해 저선량(LD) 0.05 μg의 mRNA-LNP 백신을 사용했습니다. 우리는 이전에 이 선량이 전신 항체 반응을 유도함에도 불구하고 SARS-CoV-2 도전으로부터 보호하기에 불충분하다는 것을 보여주었습니다. LD mRNA-LNPIM으로 프라이밍하고 IN 스파이크로 부스트된 쥐는 부스트 42일 후 항원 특이 폐 CD8+ TRM 세포와 BALF에서 IgA 및 IgG를 개발했습니다(그림 S4). 따라서, 낮은 수준의 면역 기억은 인 스파이크에 의한 체액 및 세포 반응의 효과적인 점막 증가를 가능하게 합니다.
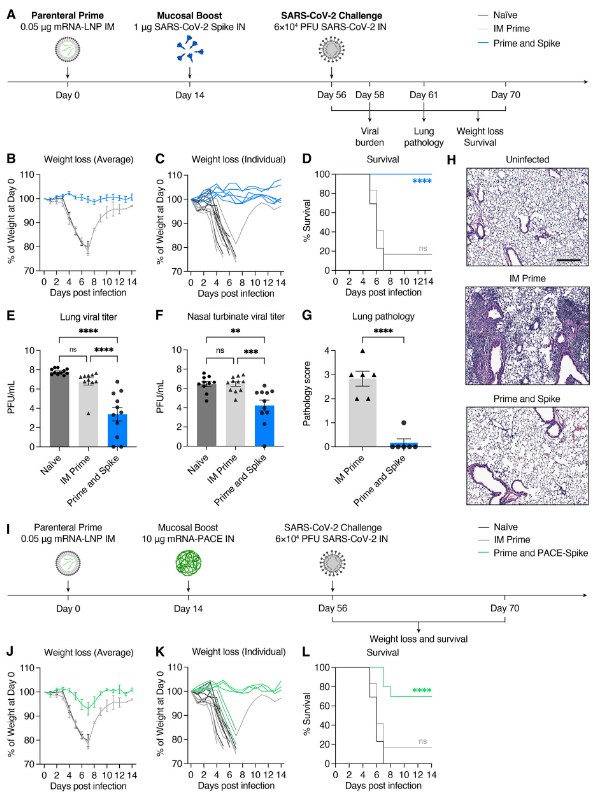
Naïve, LD prime only, or LD P&S mice were challenged with SARS-CoV-2 and assessed for viral burden at 2 days post infection (DPI), lungs pathology at 5 DPI, or monitored for weight loss and mortality for 14 days (Fig. 3A). All mice vaccinated with P&S were completely protected from weight loss or death, but neither naïve nor LD prime only mice were protected (Fig. 3, B to D). This protection was accompanied by reduced viral burden in both the upper respiratory tract (nasal turbinates) and lower respiratory tract (lungs) (Fig. 3, E and F). Furthermore, P&S led to significant protection from lung pathology with only one of six mice developing limited mononuclear infiltrates at 5 DPI (Fig. 3, G and H). Next, to assess the protective capacity of PACE-spike IN boost, we again immunized mice with LD mRNA-LNP IM and boosted them IN with PACE-spike mRNA. Prime and PACE-spike resulted in significant protection from morbidity and mortality (Fig. 3, I to L). Thus, P&S represents a robust, versatile, and safe vaccine strategy as intranasal boosting by either IN unadjuvanted spike or PACE-spike is sufficient to induce mucosal immunity and to provide protection against lethal challenge and COVID-19-like pulmonary disease.
Naveve, LD prime only 또는 LDP&S 쥐를 SARS-CoV-2에 도전하여 감염 후 2일(DPI), 폐 병리학 5일(DPI), 체중 감소 및 사망률 14일(그림 3A)을 평가했습니다. P&S 백신을 접종한 모든 쥐는 체중 감소 또는 사망으로부터 완전히 보호되었지만, 순진하거나 LD 프라임 전용 쥐는 보호되지 않았습니다(그림 3, B ~ D). 이러한 보호는 상부 호흡기(비강 터보)와 하부 호흡기(폐) 모두에서 바이러스 부담 감소를 동반했습니다(그림 3, E 및 F). 또한, P&S는 5 DPI에서 제한된 단핵 침투를 개발하는 6마리의 생쥐 중 한 마리로 폐병리학으로부터 상당한 보호를 받았습니다(그림 3, G 및 H). 다음으로, PACE-spike IN boost의 보호 용량을 평가하기 위해 다시 LD mRNA-LNPIM으로 쥐를 면역시키고 PACE-spike mRNA로 증가시켰습니다. Prime과 PACE-spike는 이환율과 사망률로부터 상당한 보호를 받았습니다(그림 3, I to L). 따라서 P&S는 점막 면역력을 유도하고 치명적인 도전과 COVID-19와 유사한 폐 질환에 대한 보호를 제공하기에 충분한 비강 내 부스팅으로 강력하고 다재다능하며 안전한 백신 전략을 나타냅니다.
Prime and Spike achieves robust systemic booster responses similar to parenteral mRNA-LNP.(프라임과 스파이크는 비경구 mRNA-LNP와 유사한 강력한 시스템 부스터 반응을 달성합니다.)
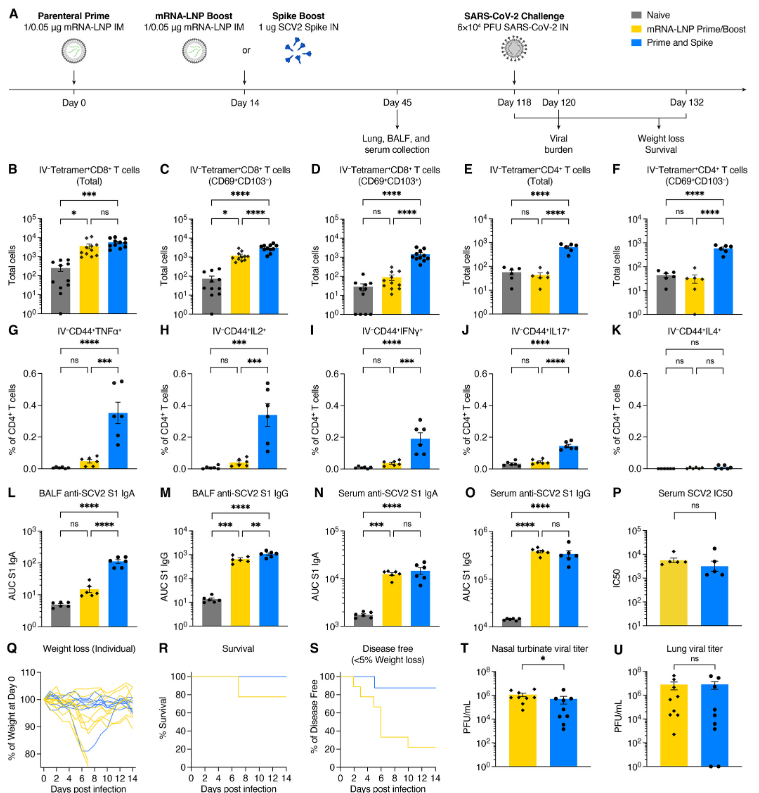
IM mRNA-LNP based boosts are the current standard. Thus, we compared systemic and mucosal immune responses in P&S- and IM mRNA-LNP prime–boost-vaccinated mice (Fig. 4A). Only P&S vaccinated animals developed lung IV-CD45−tetramer+CD8+ T cells that express CD69+ and CD103+ (Fig. 4B to D). The peptide sequence corresponding to spike 62-76 is an epitope recognized by CD4+ T cells in convalescent C57BL/6 mice (33). We therefore developed an MHC class II tetramer S62-76 (VTWFHAIHVSGTNGT) that readily identified lung-resident CD4+ T cells in both P&S and convalescent mice (fig. S5). Both infection and vaccination similarly led to increased IV-CD45−tetramer+CD4+CD69+CD103− TRM cells. P&S induced significantly higher levels of lung-resident antigen-specific CD4+ T cells that phenotypically resemble infection-induced CD4+ T cells (IV-CD45−tetramer+CD69+CD4+) (Fig. 4, E and F). To further characterize the CD4+ TRM cell response, we used a peptide stimulation assay and found that P&S led to higher number of tissue-resident CD4+ T helper type (TH)1 and TH17 but not TH2 CD4+ T cells (Fig. 4, G to K). P&S also led to the induction of polyfunctional lung resident TH1 cells (fig. S6, B to E).
IM mRNA-LNP 기반 부스트가 현재 표준입니다. 따라서 P&S-와 IM mRNA-LNP 프라임-부스트 백신을 접종한 생쥐의 전신 및 점막 면역 반응을 비교했습니다(그림 4A). P&S 백신 접종 동물들만이 폐 IV-CD45-테트라머+를 개발했습니다.CD69+ 및 CD103+를 발현하는 CD8+ T 셀입니다(그림 4B 내지 D). 스파이크 62-76에 해당하는 펩타이드 서열은 회복기 C57BL/6 마우스(33)에서 CD4+ T 세포에 의해 인식되는 에피토프입니다. 따라서 우리는 P&S와 회복기 마우스 모두에서 폐에 상주하는 CD4+ T 세포를 쉽게 식별하는 MHC 클래스 II 테트라머 S62-76(VTWF HAIHVSGT)을 개발했습니다(그림 S5). 감염과 백신 접종 모두 유사하게 IV-CD45-테트라머+를 증가시켰습니다.CD4+CD69+CD103- TRM 셀입니다. P&S는 전형적으로 감염 유발 CD4+ T 세포(IV-CD45-테트라머+)와 유사한 폐 상주 항원 특이적 CD4+ T 세포의 유의하게 높은 수준을 유도했습니다.CD69+CD4+)(그림 4, E 및 F)입니다. CD4+ TRM 세포 반응을 더욱 특성화하기 위해, 우리는 펩타이드 자극 분석을 사용했고, P&S가 조직에 상주하는 CD4+T 도우미 유형(TH)1과 TH17의 수를 증가시켰지만 TH2 CD4+ T 세포 수는 증가하지 않았다는 것을 발견했습니다(그림 4, G ~ K). P&S는 또한 다기능성 폐 상주 TH1 세포의 유도로 이어졌습니다(그림). S6, B ~ E)입니다.
P&S- but not prime–boost:vaccinated animals developed increased levels of BALF IgA (Fig. 4L). Although BALF IgG levels were increased in prime–boost relative to naïve, P&S developed significantly higher BALF IgG than prime–boost (Fig. 4M). Serum IgA and IgG in prime–boost- and P&S-vaccinated mice were similar (Fig. 4, N and O), as were neutralizing antibody levels (Fig. 4P). Thus, P&S induces similar systemic binding and neutralizing antibody levels—a correlate of protection in humans—and it uniquely elicits mucosal IgA, IgG, CD4+ TRM cells, and CD8+ TRM cells. Notably, only P&S elicits TH1 and TH17 CD4+ TRM cells and not pathogenic TH2 cell responses, which have been associated with vaccine-associated enhanced disease (VAED) (34).
P&S - 그러나 프라임 부스트 백신을 맞은 동물은 BALF IgA의 수치가 증가했습니다(그림 4L). BALF IgG 수준은 네이티브에 비해 프라임-부스트에서 증가했지만, P&S는 프라임-부스트보다 유의미하게 더 높은 BALF IgG를 개발했습니다(그림 4M). 프라임-부스트-부스트-접종된 생쥐와 P&S-백신된 생쥐의 혈청 IgA와 IgG는 유사했습니다(그림 4, N, O). 중화 항체 4P. 따라서 P&S는 유사한 전신 결합 및 중화 항체 수준(인간 보호의 상관 관계)을 유도하고 점막 IgA, IgG, CD4+ TRM 세포 및 CD8+ TRM 세포를 특이하게 유도합니다. 특히, P&S만이 TH1 및 TH17 CD4+ TRM 세포를 추출하고 병원성 TH2 세포 반응은 유도하지 않으며, 이는 백신 관련 강화 질병(VAED)(34)과 관련이 있습니다.
To compare the protective efficacy of P&S to mRNA-LNP prime–boost, mice were primed with LD mRNA-LNP and boosted with either LD mRNA-LNP (IM) or unadjuvanted spike protein (IN). Mice were challenged 118 days post prime. Both vaccine strategies lead to roughly equivalent protection from death with 2/9 prime–boost mice and 0/9 P&S mice succumbing to infection (Fig. 4, Q and R). P&S led to significantly enhanced disease-free survival indicated by only 1/9 mice losing >5% of initial body weight, whereas 6/9 mRNA-LNP prime–boost mice lost >5% of their starting body weight (Fig. 4S). P&S also led enhanced upper airway protection indicated by decreased nasal turbinate viral load and reduced, although not statistically significant lower airway viral load (Fig. 4, T and U).
P&S의 보호 효능을 mRNA-LNP 프라임-부스트와 비교하기 위해, 생쥐를 LD mRNA-LNP로 프라이밍하고 LD mRNA-LNP(IM) 또는 무증강 스파이크 단백질(IN)로 프라이밍했습니다. 생쥐는 프라임 후 118일 후에 도전을 받았습니다. 두 백신 전략 모두 2/9 프라임 부스트 마우스 및 0/9 P&S 마우스가 감염에 굴복하여 사망으로부터 대략 동등한 보호를 제공합니다(그림 4, Q 및 R). P&S는 초기 체중 중 > 5%를 감량한 반면, 6/9 mRNA-LNP 프라임-부스트 생쥐는 초기 체중 > 5%를 감량하여 질병이 없는 생존을 크게 향상시켰습니다(그림 4S). P&S는 또한 통계적으로 유의미한 낮은 기도 바이러스 부하(그림 4, T 및 U)는 아니지만, 코 터브네이트 바이러스 부하 감소와 감소에 의해 나타나는 향상된 기도 보호 기능을 이끌었습니다.
Prime and Spike reduces transmission in a hamster model of SARS-CoV-2(프라임과 스파이크는 SARS-CoV-2의 햄스터 모델에서 전염을 줄입니다.)
Next, we used Syrian hamsters to both assess the viability of P&S in an alternate SARS-CoV-2 model and its ability to reduce transmission. Hamsters were vaccinated either by IM mRNA-LNP prime–boost or P&S (Fig. 5A). Serum IgA and IgG levels at 67 days post prime were equivalent between the two groups (Fig. 5, B and C). Hamsters were infected with SARS-CoV-2 at 93 days post prime and both groups were equivalently protected from disease, indicated by minimal weight loss and reduced lung pathology relative to naïve animals (Fig. 5, D and E). P&S-vaccinated animals cleared viral shedding more quickly relative to naïve controls starting at 4 DPI, with all oral swabs negative for infectious virus by 5 DPI. Conversely, mRNA-LNP prime–boost animals did not have significantly lower titers at 4 or 5 DPI and did not stop shedding virus until 6 DPI. Cumulative viral shedding assessed by area under the curve (AUC) revealed that both mRNA-LNP prime–boost and P&S vaccinated animals had significantly lower overall viral shedding than naïve animals. Although P&S AUC was less than mRNA-LNP prime–boost, the results were not statistically significant.
다음으로, 우리는 시리아 햄스터를 사용하여 대체 SARS-CoV-2 모델에서 P&S의 실행 가능성과 전염을 줄일 수 있는 능력을 평가했습니다. 햄스터는 IM mRNA-LNP prime-boost 또는 P&S(그림 5A)를 통해 백신을 접종했습니다. 프라임 후 67일 동안의 혈청 IgA와 IgG 수치는 두 그룹(그림 5, B 및 C)에서 동일했습니다. 햄스터는 전성기 이후 93일 만에 SARS-CoV-2에 감염되었으며 두 그룹 모두 질병으로부터 동등하게 보호되었으며, 이는 순진한 동물에 비해 최소 체중 감소와 폐 병리 감소를 나타냅니다(그림 5, D 및 E). P&S 백신을 접종한 동물들은 4 DPI에서 시작하는 네이티브 대조군에 비해 바이러스 유출을 더 빨리 제거했으며, 모든 구강 면봉은 5 DPI만큼 감염 바이러스에 대해 음성입니다. 반대로, mRNA-LNP 프라임-부스트 동물은 4 또는 5 DPI에서 유의하게 낮은 역가를 가지지 않았고 6 DPI까지 바이러스 유출을 멈추지 않았습니다. 곡선(AUC)에 따라 면적별로 평가된 누적 바이러스 유출은 mRNA-LNP 프라임-부스트 및 P&S 백신 접종 동물 모두 원시 동물보다 전체 바이러스 유출이 유의하게 낮다는 것을 드러냈습니다. P&S AUC는 mRNA-LNP 프라임-부스트보다 작았지만, 결과는 통계적으로 유의하지 않았습니다.
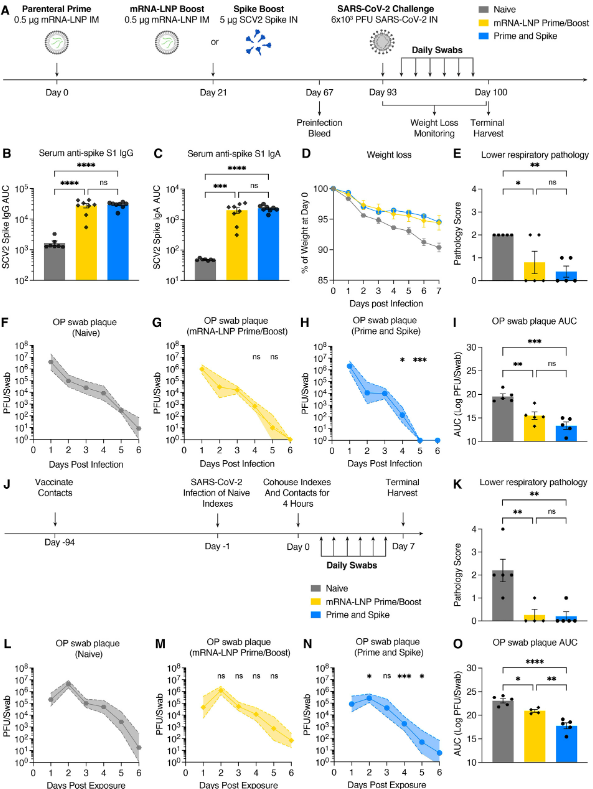
Although P&S reduced viral shedding after infection, whether P&S was able to reduce transmission to vaccinated animals was not yet determined. Vaccinated hamsters were therefore cohoused with naïve donor hamsters who had been infected 24 hours prior (Fig. 5J). P&S vaccinated contact hamsters had significantly lower viral titers at days 2, 4, and 5 post exposure relative to naïve, whereas mRNA prime–boost-vaccinated animals did not have significantly reduced viral shedding at any single time point post exposure (Fig. 5, L to N). Both P&S and mRNA prime–boost were equally protected from lower respiratory tract pathology in the setting of transmission (Fig. 5K and fig. S7). Notably, peak viral load (at 2 DPI) and cumulative viral shedding were significantly reduced in P&S animals relative to both naïve and mRNA-LNP prime–boost contact hamsters (Fig. 5O). Thus, P&S appears to be an effective vaccine strategy in hamsters and reduces viral transmission.
비록 P&S가 감염 후 바이러스 유출을 줄였지만, P&S가 예방 접종을 받은 동물에 대한 전염을 줄일 수 있었는지 여부는 아직 결정되지 않았습니다. 따라서 예방접종을 받은 햄스터는 24시간 전에 감염된 순진한 기증자 햄스터와 함께 보관되었습니다(그림 5J). P&S 예방접종을 받은 접촉 햄스터는 네이티브에 비해 2, 4, 5일차에 바이러스 역가가 유의미하게 낮았던 반면, mRNA 프라임-부스트 예방접종을 받은 동물은 노출 후 어느 시점에서도 바이러스 유출이 유의미하게 감소하지 않았습니다(그림 5, L ~ N). P&S와 mRNA prime-boost는 모두 전염 환경에서 하부 호흡기 병리학으로부터 동등하게 보호되었습니다(그림 5K 및 그림 S7). 특히, P&S 동물에서 최대 바이러스 부하(2 DPI에서)와 누적 바이러스 방출은 순진한 접촉 햄스터와 mRNA-LNP 프라임-부스트 접촉 햄스터에 비해 유의하게 감소했습니다(그림 5O). 따라서, P&S는 햄스터에게 효과적인 백신 전략으로 보이며 바이러스 전염을 감소시킵니다.
Heterologous spike robustly elicits cross-reactive immunity.(이질적인 스파이크는 교차 반응 면역을 강력하게 유도합니다.)
Boosting at a distinct anatomic location—in this case the respiratory mucosa—by homologous unadjuvanted subunit spike enables the formation of new mucosal immune memory and enhances systemic immunity. However, VOCs such as current Omicron sublineages have significant changes to the spike protein sequence, leading to evasion of pre-existing humoral immunity. It is likely that future variants will diverge even more, suggesting a boosting strategy that elicits broadly reactive immunity will be necessary to neutralize future variants.
상동성 무증강 서브유닛 스파이크에 의해 별개의 해부학적 위치(이 경우 호흡 점막)에서 부스팅하면 새로운 점막 면역 기억의 형성을 가능하게 하고 전신 면역력을 향상시킵니다. 그러나 현재 오미크론 하위 계통과 같은 VOCs는 스파이크 단백질 시퀀스에 상당한 변화를 가져 기존 체액 면역의 회피로 이어집니다. 미래의 변종은 훨씬 더 다양해질 가능성이 높으며, 이는 미래의 변종을 무력화하기 위해 광범위한 반응성 면역력을 도출하는 부양 전략이 필요할 것임을 시사합니다.
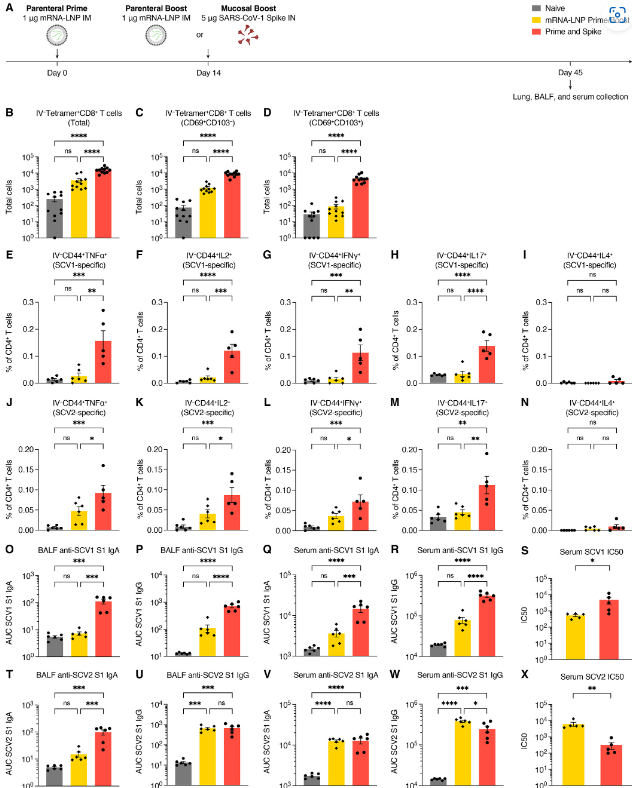
To test the ability of an unadjuvanted heterologous spike (Spike X) protein in P&S, mice were primed with SARS-CoV-2 mRNA-LNP followed by IN boosting with SARS-CoV-1 spike which we refer to as P&Sx (Fig. 6A). Although SARS-CoV-1 is a related sarbecovirus, its spike protein only shares 76% homology with SARS-CoV-2 spike. At 45 days post prime, there were increased IV-CD45− tetramer+ CD8+ TRM cells (Fig. 6, B to D). The MHC I tetramer sequence was highly conserved within the sarbecovirus family (fig. S5A). We performed peptide stimulation assay using both SARS-CoV-1 and SARS-CoV-2 peptide pools to assess the development of antigen-specific lung CD4+ TRM cells. We found that P&Sx led to both the development of SARS-CoV-1 and to a lesser extent SARS-CoV-2 specific antigen-specific TH1 and TH17 CD4+ TRM cells and no induction of CD4+ TRM expressing the TH2 cytokine IL-4 (Fig. 6, E to N, and fig. S8). There were also increased anti-SARS-CoV-1 IgA and IgG in both the BALF and serum in P&Sx relative to IM mRNA-LNP prime-boost (Fig. 6, O to R). P&Sx mice correspondingly developed higher neutralization titers against SARS-CoV-1 than mice vaccinated with SARS-CoV-2 mRNA-LNP prime–boost (Fig. 6S). P&Sx induced higher anti-SARS-CoV-2 BALF IgA than SARS-CoV-2 mRNA-LNP prime–boost and similar levels of anti-SARS-CoV-2 IgG in BALF (Fig. 6, T and U). Consistent with the elevated serum IgG levels, mRNA-LNP prime–boost mice had higher serum neutralization titers against SARS-CoV-2 than P&Sx mice (Fig. 6, V to X). Thus, IN boosting with unadjuvanted heterologous spike protein can induce potent mucosal cellular and humoral memory against a significantly divergent sarbecovirus.
P&S에서 비보조 이종 스파이크(Spike X) 단백질의 능력을 테스트하기 위해, 쥐를 SARS-CoV-2 mRNA-LNP로 프라이밍한 후 우리가 P&Sx라고 부르는 SARS-CoV-1 스파이크로 IN 부스팅했습니다(그림 6A). SARS-CoV-1은 관련 사르베코 바이러스이지만, 스파이크 단백질은 SARS-CoV-2 스파이크와 76%의 상동성을 공유합니다. 프라임 후 45일 동안 IV-CD45-테트라머+CD8+TRM 세포가 증가했습니다(그림 6, B ~ D). MHCI 테트라머 시퀀스는 사르베코바이러스 계열 내에서 매우 보존되었습니다(그림 S5A). 항원 특이 폐 CD4+ TRM 세포의 발달을 평가하기 위해 SARS-CoV-1 및 SARS-CoV-2 펩타이드 풀을 모두 사용하여 펩타이드 자극 분석을 수행했습니다. 우리는 P&Sx가 SARS-CoV-1과 덜한 정도 SARS-CoV-2 특이 항원 특이적 TH1 및 TH17 CD4+ TRM 세포의 개발로 이어졌고 TH2 사이토카인 IL-4를 발현하는 CD4+ TRM의 유도가 없다는 것을 발견했습니다(그림 6, E to N, 및 그림 8). 또한 IM mRNA-LNP 프라임 부스트에 비해 P&Sx의 BALF와 혈청 모두에서 항SARS-CoV-1 IgA와 IgG가 증가했습니다(그림 6, O to R). 이에 따라 P&Sx 생쥐는 SARS-CoV-2 mRNA-LNP 프라임-부스트를 백신 접종한 생쥐보다 SARS-CoV-1에 대해 더 높은 중화 억제제를 개발했습니다(그림 6S). P&Sx는 SARS-CoV-2 mRNA-LNP 프라임 부스트보다 더 높은 반SARS-CoV-2 BALF IgA와 BALF에서 유사한 수준의 반SARS-CoV-2 IgG를 유도했습니다(그림 6, T 및 U). 혈청 IgG 수준이 높아진 것과 일관되게, mRNA-LNP 프라임-부스트 마우스는 P&Sx 마우스보다 SARS-CoV-2에 대한 혈청 중화 역가가 더 높았습니다(그림 6, V ~ X). 따라서, 이질적인 스파이크 단백질로 IN 부스팅을 하면 상당히 다른 사르베코바이러스에 대해 강력한 점막 세포 및 체액 기억을 유도할 수 있습니다.
Discussion(토론)
Here we describe the preclinical development of an alternative vaccine strategy, P&S, whereby IN unadjuvanted spike subunit protein elicits robust protective mucosal immunity following mRNA-LNP parenteral immunization. These enhanced mucosal responses are characterized by the expansion of antigen-specific CD8+ TRM, CD4+ TRM, and BRM cells as well as mucosal secretion of IgA and IgG. We find that an IN unadjuvanted spike booster can be administered months out from primary immunization and that it offers comparable systemic neutralizing antibody booster responses to IM mRNA-LNP boost. Similarly, Prime and PACE-spike elicits increased antigen-specific CD8+ TRM cells and mucosal IgA. Both boosting methods result in protection from lethal SARS-CoV-2 challenge. We also find that P&S leads to durable responses with protective vaccine efficacy at 118 days from the initiation of vaccination. P&S is protective in hamsters and blocks viral transmission more effectively than mRNA-LNP prime–boost. Finally, by utilizing a divergent spike antigen, we demonstrate that P&Sx can generate mucosal immunity to SARS-CoV-1, while also boosting the systemic and mucosal neutralizing antibodies to the original antigenic target, SARS-CoV-2. Although the goal of vaccination has been to prevent individual morbidity and mortality, the evolution of SARS-CoV-2 has highlighted the need for rapidly deployable mucosal vaccines that also prevent transmission. P&S shows promise in reducing both infection and transmission. Improving upon current vaccine platforms to provide mucosal immunity is vital to control this pandemic and will certainly be important for the next.
여기서 우리는 MRNA-LNP 비경구 면역에 따른 강력한 보호 점막 면역성을 유도하는 대체 백신 전략인 P&S의 사전 임상 개발에 대해 설명합니다. 이러한 강화된 점막 반응은 IgA와 IgG의 점막 분비뿐만 아니라 항원 특이적 CD8+ TRM, CD4+ TRM 및 BRM 세포의 확장으로 특징지어집니다. 우리는 IN 비보조 스파이크 부스터가 일차 면역으로부터 몇 달 후에 투여될 수 있으며 IM mRNA-LNP 부스트와 유사한 전신 중화 항체 부스터 반응을 제공한다는 것을 발견했습니다. 마찬가지로 프라임 및 PACE 스파이크는 항원 특이적 CD8+ TRM 세포와 점막 IgA를 증가시킵니다. 두 가지 증강 방법 모두 치명적인 SARS-CoV-2 도전으로부터 보호됩니다. 우리는 또한 P&S가 백신 접종 시작일로부터 118일 만에 보호 백신 효능으로 지속적인 반응을 이끈다는 것을 발견했습니다. P&S는 햄스터에서 보호되며 mRNA-LNP 프라임-부스트보다 바이러스 전달을 더 효과적으로 차단합니다. 마지막으로, 발산 스파이크 항원을 사용함으로써, 우리는 P&Sx가 SARS-CoV-1에 대한 점막 면역력을 생성하는 동시에 원래의 항원 표적인 SARS-CoV-2에 대한 전신 및 점막 중화 항체를 증가시킬 수 있음을 보여줍니다. 백신 접종의 목표는 개인의 이환율과 사망률을 막는 것이었지만, SARS-CoV-2의 진화는 전염을 막는 신속한 배치형 점막 백신의 필요성을 강조했습니다. P&S는 감염과 전염을 모두 감소시킬 수 있는 가능성을 보여줍니다. 현재 백신 플랫폼을 개선하여 점막 면역을 제공하는 것은 이 전염병을 제어하는 데 필수적이며 다음 번에도 분명 중요할 것입니다.
Preclinical studies of both SARS-CoV-2 and influenza have demonstrated that intranasal vaccination decreases viral shedding and transmission relative to parenteral vaccines (19–23). Despite these studies, there is only one currently approved respiratory mucosal vaccine, FluMist, which relies on a live attenuated influenza virus. FluMist is contraindicated in people with underlying respiratory conditions and is only approved for young people. Additionally, live attenuated vaccines are not amenable to rapid implementation, as this technology require extensive research and development. Accordingly, most current clinical trials of mucosal administered SARS-CoV-2 vaccines rely on either replication-deficient or attenuated viral vectors. However, the safety and efficacy of these approaches have not yet been established, especially given that preexisting immunity to these vectors can lead to reduced immunogenicity (35). Indeed, some vector-based mucosal vaccines—including two Merck candidates V590 and V591—have already been abandoned after phase 1 clinical trials showed poor immunogenicity, while candidates by Bharat Biotech and CanSino have recently been approved (36).
SARS-CoV-2와 인플루엔자에 대한 임상 전 연구는 비경구 백신(19-23)에 비해 비경구 백신에 비해 비경구 백신에서 바이러스 유출과 전염이 감소한다는 것을 입증했습니다. 이러한 연구에도 불구하고, 현재 승인된 호흡기 점막 백신인 플루미스트는 살아있는 감쇠 인플루엔자 바이러스에 의존하고 있습니다. 플루미스트는 호흡기 질환이 있는 사람들에게 금지되며 젊은 사람들에게만 승인됩니다. 또한 라이브 감쇠 백신은 광범위한 연구와 개발이 필요하기 때문에 신속한 구현에 적합하지 않습니다. 따라서, 점막 투여 SARS-CoV-2 백신의 현재 임상 실험은 복제 결핍 또는 약화된 바이러스 벡터에 의존합니다. 그러나 이러한 벡터에 대한 기존 면역이 면역원성을 감소시킬 수 있다는 점에서 이러한 접근법의 안전성과 효과는 아직 확립되지 않았습니다(35). 실제로, 2개의 Merck 후보 V590과 V591을 포함한 일부 벡터 기반 점막 백신은 임상 1상에서 면역원성이 좋지 않은 것으로 나타났고, Bharat Biotech와 CanSino의 후보들은 최근에 승인되었습니다.
P&S is likely broadly applicable as a booster against new SARS-CoV-2 VOCs in a previously vaccinated individual or as a de novo primary immunization strategy for newly emerging respiratory pathogens. Although it is possible that our results rely on specific characteristics of mRNA-LNP priming, we believe that this approach will likely work with other primary immunization regimens or in the case of previous infection. Although the above study assesses a single mRNA-LNP dose prior to IN boosting, we would expect unadjuvanted IN boosting to be as effective if not more so in individuals who have received multiple previous shots, because P&S seems to leverage pre-existing immunity rather than be inhibited by it. Additionally, it has been shown that the highly stabilized spike enhances its immunogenicity and that applying this vaccination strategy to other pathogens may require the addition of stabilizing mutations to enable unadjuvanted boosting. Our present study characterizes a method for the development of mucosal immunity to SARS-CoV-2 without the use adjuvants or replicating viruses or vectors in two different well-validated pre-clinical vaccine models. These results are encouraging but require further validation and optimization for human use.
P&S는 이전에 백신 접종을 받은 개인의 새로운 SARS-CoV-2 VOCs에 대한 부스터 또는 새롭게 부상하는 호흡기 병원체에 대한 새로운 일차 면역 전략으로 광범위하게 적용될 수 있습니다. 비록 우리의 결과가 mRNA-LNP 프라이밍의 특정 특성에 의존할 수 있지만, 우리는 이 접근법이 다른 1차 면역 요법이나 이전 감염의 경우에서 작동할 가능성이 높다고 믿습니다. 위의 연구는 IN 부스팅 전에 단일 mRNA-LNP 선량을 평가하지만, P&S가 기존 면역에 의해 억제되기보다는 기존 면역력을 활용하는 것 같기 때문에 이전 주사를 여러 번 맞은 개인에서 비부스팅이 더 효과적일 것으로 예상됩니다. 또한, 고도로 안정화 된 스파이크는 면역원성을 향상시키며, 이 예방접종 전략을 다른 병원체에 적용하는 것은 부가되지 않은 부스팅을 가능하게 하기 위해 안정화 돌연변이의 추가를 요구할 수 있다는 것을 보여주었습니다. 우리의 현재 연구는 보조제를 사용하거나 잘 검증된 두 가지 사전 임상 백신 모델에서 바이러스나 벡터를 복제하지 않고 SARS-CoV-2에 대한 점막 면역력을 개발하는 방법을 특징짓습니다. 이러한 결과는 고무적이지만 인간 사용에 대한 추가 검증 및 최적화가 필요합니다.
Vaccines that generate broadly neutralizing immunity against a wide variety of sarbecoviruses are a goal to combat both newly emerging SARS-CoV-2 variants and potential pandemic SARS-like coronaviruses. Utilizing SARS-CoV-1 spike as a heterologous IN boost, P&Sx demonstrates that prior SARS-CoV-2 mRNA-LNP does not prevent the development of SARS-CoV-1 neutralizing antibodies, but rather enables it. P&Sx simultaneously elicits broadly reactive neutralizing antibodies and mucosal immunity. Although some recent studies have successfully reported the development of systemic pan-sarbecovirus vaccines (37, 38), P&Sx induces both systemic and mucosal immunity against both SARS-CoV-1 and SARS-CoV-2.
광범위한 사르베코 바이러스에 대한 광범위한 중화 면역력을 생성하는 백신은 새롭게 부상하는 사스-CoV-2 변종과 잠재적인 전염병 사스와 유사한 코로나바이러스와 싸우는 목표입니다. P&Sx는 SARS-CoV-1 스파이크를 이질적인 IN 부스트로 활용하여 이전의 SARS-CoV-2 mRNA-LNP가 SARS-CoV-1 중화 항체의 개발을 막는 것이 아니라 이를 가능하게 한다는 것을 입증합니다. P&Sx는 광범위한 반응성 중화 항체와 점막 면역을 동시에 유도합니다. 일부 최근 연구는 전신 범사르베코바이러스 백신(37, 38)의 개발을 성공적으로 보고했지만, P&Sx는 SARS-CoV-1과 SARS-CoV-2 모두에 대해 전신 및 점막 면역 모두를 유도합니다.
SARS-CoV-2 will continue to evolve and become more immune evasive and transmissible. We will require boosting in human populations for the foreseeable future. Boosting that induces mucosal immunity may help enhance protection and slow transmission as these new variants emerge.
사스-CoV-2는 계속 진화할 것이고 면역 회피와 전염성이 더 강해질 것입니다. 우리는 가까운 미래에 인구 증가를 요구할 것입니다. 점막 면역력을 유도하는 증강은 이러한 새로운 변종이 나타날 때 보호를 강화하고 전염 속도를 늦추는 데 도움이 될 수 있습니다.







